【重磅干货】FDA OOS 指南修订内容对比和解析
发布时间:2022-05-20 浏览次数:3101
5月16日,FDA 发布对 2006 年《药品生产中 OOS 检测结果的调查指南》的修订指南。
主要修订点:
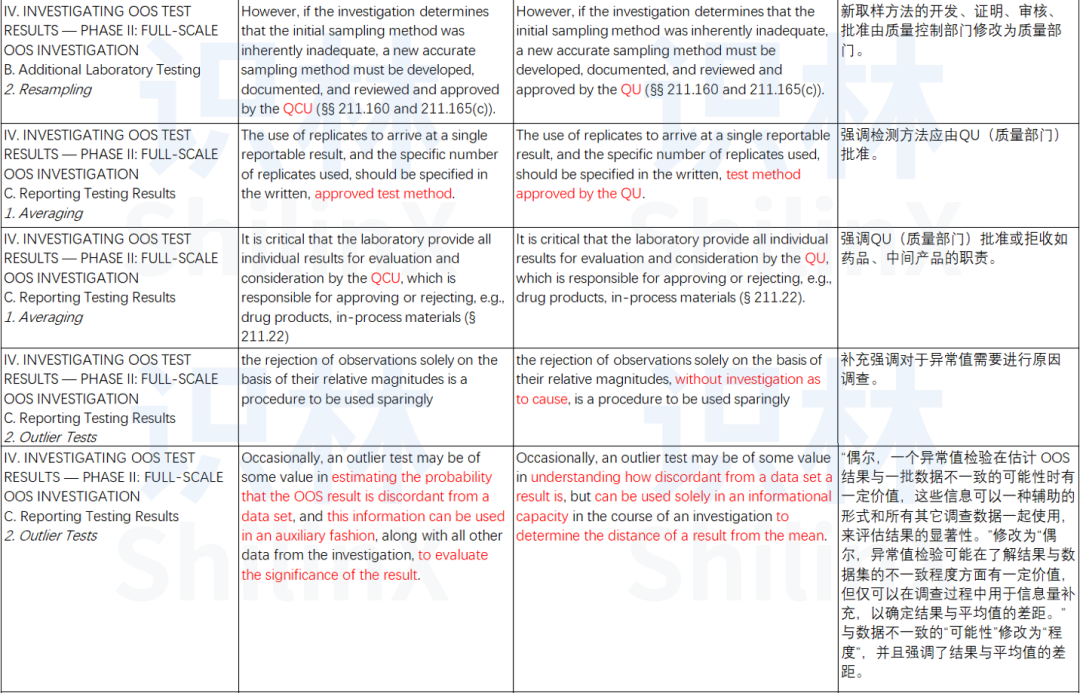
更新了术语以与当前 FDA 指南保持一致,例如,将质量控制部门更改为质量部门;
提高了对调查根本原因的要求;
澄清了与处理异常结果相关的概念;
补充了与 OOS 结果平均相关的实践。
本文以表格形式对新版指南的主要修订内容进行对比和解析。
表1. FDA OOS 指南2022版与2006版主要修订内容对比、解析



内容来源:IDMF药械之家
提醒:文章内容用于学习和交流,仅供参考!如文章涉及侵权或不愿我平台发布,请联系处理。






