细胞传代方法和注意事项
发布时间:2023-03-28 浏览次数:5084
传代培养几乎是所有细胞生物学实验的基础。当细胞在培养瓶中长到一定密度都会因为接触抑制而停止生长,之后就需要将其稀释分种成多瓶,细胞才能继续生长。这一过程就叫传代。传代培养可获得大量细胞供实验所需,但培养皿中的细胞很容易受到外界污染,所有操作要在严格的无菌条件下进行。
今天为大家分享细胞传代(以HEK-293T细胞传代为例)的方法和注意事项。

实验器材
材料:培养瓶/皿,离心管,移液管,移液器,废液缸,75%酒精,所需培养细胞。
药品:DMEM培养基,小牛血清或胎牛血清,0.25%胰蛋白酶,PBS缓冲液,青链霉素双抗。
仪器:CO₂培养箱,显微镜,超净台。

实验步骤
以HEK-293T细胞传代为例
1. 从培养箱拿出细胞,镜下观察细胞状态,并判断是否达到了可传代的密度;

2. 回到超净台中,吸去培养基,加入2ml左右PBS,轻轻晃动培养瓶润洗细胞,吸去PBS,加入0.25%胰酶,轻轻晃动培养瓶使之浸润所有细胞;
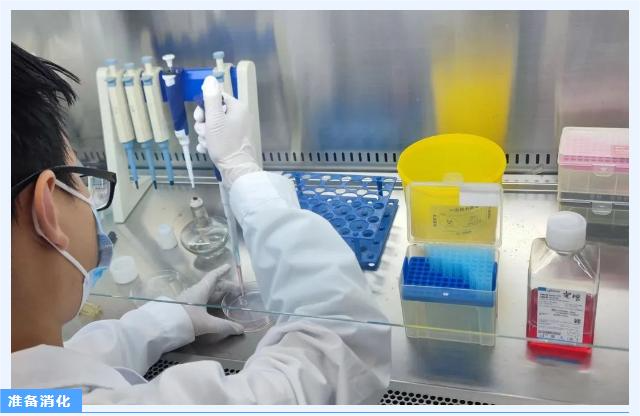
3. 放入37℃培养箱,开始消化并计时,消化时间跟据细胞特性有所不同,例如HEK-293T细胞消化时间为2min;

4. 用含10%血清的DMEM培养基终止,通过反复吹打使细胞脱离培养皿底部,尽量呈单颗细胞的悬浮液(可以在显微镜下观察);

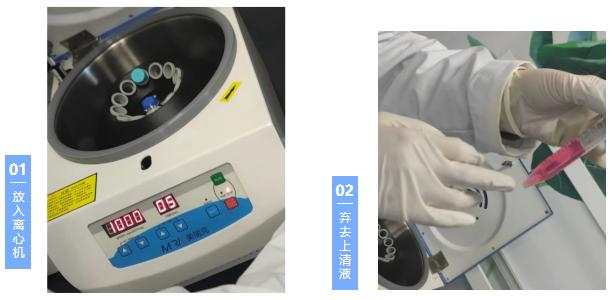
5. 收集细胞悬液离心,室温下1200rpm,5min(不同细胞离心参数设置不同),离心完吸出上清丢弃(此时可以看到细胞在管底形成肉眼可见的细胞团块,团块大小与细胞多少有关,拿取过程中小心不要发生碰撞);
6. 在新的培养皿种加入新鲜培养基,用新鲜培养基将细胞重悬,吹打几下混匀细胞,将细胞接种到新培养皿,摇晃混匀;
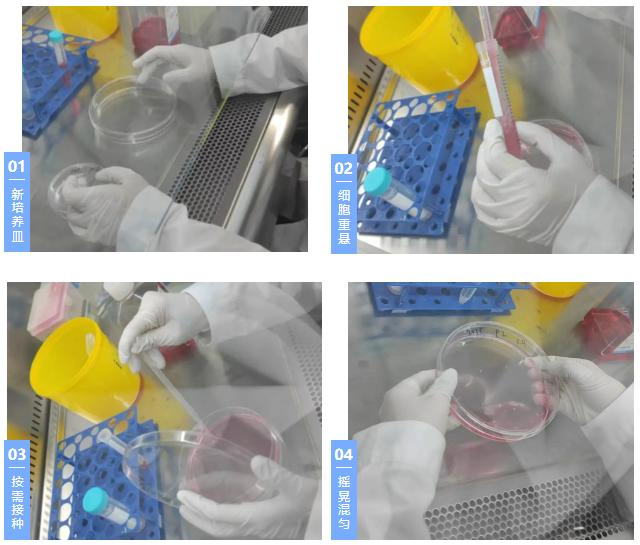
7. 将培养皿放入培养箱。
注意事项
1. 无菌操作规范:在实验开始前和结束后,需要将超净台紫外照射灭菌30min,要穿好灭菌服,戴好灭菌手套和口罩。
2. 所有物品从外面移入超净台都需要喷洒75%酒精消毒,并且同样用75%酒精消毒双手。
3. 使用胰酶消化细胞要把握好时间,切勿消化过度,及时终止消化。如果消化不够充分可以轻拍培养皿帮助细胞脱落。
4. 弃上清的动作需一次完成,切忌抬起管口,让液体流回底部后,又再次倾倒。回流的液体会把细胞团块冲散甚至冲起来,再倾倒有把细胞团块倒掉的风险。
5. 养成在培养皿上做标记的习惯,注明传代时间,细胞种类。

来源:“Bioqure”公众号
说明:转载只为分享目的,如有侵权请联系删除,谢谢!






