食品及加工过程致病菌可混样检验吗?
发布时间:2023-08-16 浏览次数:570
来源:六扇门Study公众号
对于重度/极重度危害的致病菌,如沙门氏菌、大肠埃希氏菌O157:H7、单核细胞增生利斯特氏菌、婴幼儿食品中克罗诺杆菌属等致病菌一般为零容忍,采样二级采样方案,即m=0(不得检出)。
对于这类“不得检出”要求的致病菌通常采用先增菌的方式来提高致病菌检出率,多数致病菌要求m=0 CFU/25g(mL),25g(mL)样本加到对应标准要求的225mL增菌液中进行增菌,之后再进行分离、鉴定等。
按照二级采样方案一般n=5,也就是每批次要取5个样品进行检测,那是否可以并样增菌检测,或者先增菌然后混样检测呢?
致病菌混样检测是否有参考依据呢?
✨ICMSF8中提到“如果方法已经经过验证,可在增菌后检测到单个细菌的生长,则可多个样品(如5、10、15、20等)混样进行一次检验。”
✨ISO22964-2017克罗诺杆菌属检验方法标准中也提出:针对10g检测部分已经进行了验证,如果是大于10g(如混样)需要进行验证以确保检测准确性。
✨ISO6571-1-2017沙门氏菌检验方法标准中也提出:针对25g检测部分已经进行了验证,如果是大于25g(如混样)需要进行验证以确保检测准确性;大体积样本(如BPW大于1L)推荐并样前将BPW预温到34-38°C。
✨《生鲜农产品行业李斯特菌环境监测和控制指南》中也提出了环境采样样本混样检测的要求:
为了节省资金,采样时会选择合成2-5个样本(例如,在多个表面使用相同的拭子/海绵)。
如果拭子是从一个区域合成的,如果出现阳性,处理措施一致,那么混合测试可能是合适的。
另一方面,混合检测可能会稀释目标生物的灵敏度。在大多数情况下,混合采样不会提供关于哪个地点是阳性的信息,一旦混合样检出阳性,必须重新分开取样测试。在许多这种情况下,这增加了重新采样和重新测试的额外时间和成本。
今日话题:混样检测是否有被验证过?
B. Jarvis在文献《On the compositing of samples for qualitative microbiological testing》中验证并阐述了混样检测需要考虑的实际因素。跟大家分享几点内容:
分享内容1:
需要考虑检测样本中菌群的状态,这是前提!
(1)测试样品被目标菌和竞争菌群污染的初始水平;
(2)目标菌和竞争菌群的初始状态(如亚致死损伤);
(3)在检测条件下(时间、温度、培养基中抑制剂的存在等),目标菌和竞争菌群的生长趋势。
分享内容2:
增菌要求,1ml预增菌培养物中至少可被转移1个目标菌
为了确保在1ml预增菌培养物中至少可被转移1个目标菌,要求1ml培养物中至少平均存在7个活菌。类似的考虑也适用于将目标菌从增菌培养转移到分离琼脂平板。如下表所示。
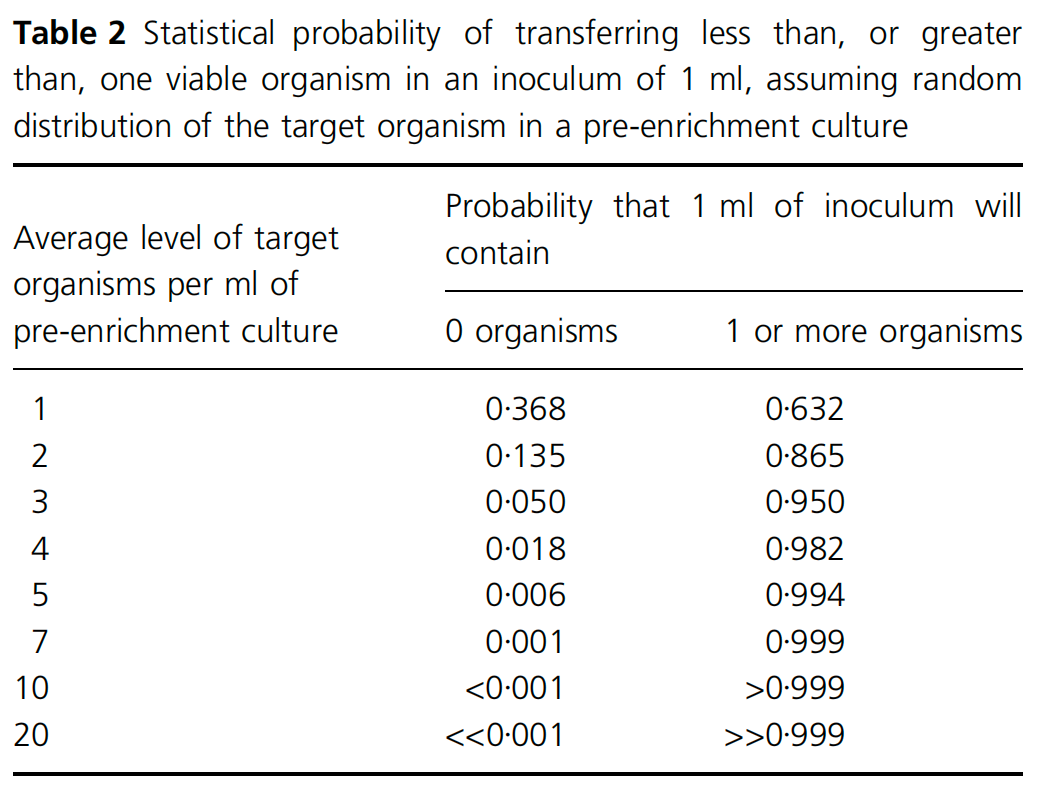
假设每25g样品加入到225mL培养基中的样品中有一个亚致死受损的目标致病菌,每ml培养物中至少平均出现7个活菌,250mL的增菌液中至少需要1750个活菌。这将需要至少11代(2048>1750)。根据培养温度和竞争微生物可能产生的抑制作用,这可能需要增菌至少12小时以上(Jarvis 1989)。如果接种量较小(例如一个活菌在250 g合成样品),最小孵育时间可能超过12小时。
分享内容3:
如果混样检测,方法体系如何选择和验证?
在选择混样检测之前,有必要验证每个食品大类的检验方法,以确保说明该方法的灵敏度足够高,可以检测到目标菌。
验证要求必须确定该方法的灵敏度,理想情况下使用自然污染的食品基质,以达到混样检测可能遇到的最低污染水平。
在实际检验中,这要求该方法足够灵敏,可以检测到食品基质中最大混样量(如250g或500g)的一个目标活菌。否则即使可以在25g中检测到一个目标活菌,也不能确定该方法是否适用于混样检测,否则会造成结果假阴性。
以沙门氏菌检测为例,
分析几种混样检测的方法
假设某食品基质检测要求是每批次30个样本,每个样本取25g。为了降低工作量,有时建议将初始样本单元混样成少量的较大的测试样本进行检测。下面分析几种混样检测方案。
方法1: 将30 x 25 g样品单元(即750 g)混合成一个均匀混合的样品,从中取一个25g进行检验分析。这种方法只测试一个具有代表性的25 g样品单位,阴性结果没有意义。—无效方法
方法2: 将30 x 25 g样品单位随机合成3组,以每组10 x 25 g样品单位,将每个250 g复合样品接种到2.25L的增菌液中, 培养结束后,根据三种增菌液进行后续的培养和检测程序。只要该方法能够检测250g产品中的1个活的沙门氏菌,且该方法已被验证,该方法就是有效的,如果没有验证,也属于无效方法。
方法3: 将30个样本单独进行增菌,增菌后将30个前增菌液中的1 ml(共30mL)转移到选择性增菌培养基中进一步增菌,然后进行接下来的检测操作。且可以存储原始的前增菌液,等待测试结果。
如果获得了阳性结果,就可以回到原始的前增菌液中,通过进一步测试有多少个受污染的样本存在来评估。这种方法的好处是,检测30个样本的概念没有受到损害,因为混样只是在增菌后进行的。—比较科学有效的方法






