DNA提取基本知识(裂解与纯化详细介绍!)
发布时间:2023-08-23 浏览次数:7568
DNA提取分为裂解和纯化两大步骤,裂解的目的是破坏样品细胞结构,使细胞中的DNA游离在裂解体系中,纯化的目的是使DNA与裂解体系中的其它组分(蛋白质、盐、多酚等)分离。
裂 解
常规的裂解液都含有去污剂(如SDS、CTAB、Triton X-100、NP-40、Tween 20等)和盐(如Tris、EDTA、NaCl等)。去污剂能使蛋白质变性、破坏膜结构,同时去除与核酸相互结合的蛋白质。盐能够提供合适的裂解环境、抑制核酸酶的降解作用,维持核酸结构稳定。
裂解体系中还可能加入蛋白酶,利用蛋白酶将蛋白质消化成小的片段,促进DNA与蛋白质的分离,同时也便于后续的纯化操作。
纯 化
沉淀法
利用酚/氯仿抽提去除蛋白质,再用乙醇或异丙醇沉淀DNA。
* 酚氯仿抽提是去除蛋白质的有效手段,但如果蛋白质含量超过了其饱和度,裂解体系中的蛋白质就不会被一次性去除,需要进行多次反复抽提,而每次的抽提均会导致核酸的损失。

图1 沉淀法DNA提取过程示意图
离心柱法
通过离心柱上的吸附膜,特异性吸附DNA。
* 离心柱法受人为操作因素影响小,提取DNA的纯度稳定性很高,其缺点是当样品过量时,需反复进行离心,对样品的提取效率较低。

图2 离心柱法DNA提取过程示意图
磁珠法
将纯化介质包被在纳米级的磁珠表面,通过介质对DNA的吸附作用,在外加磁场的作用下使DNA附着于磁珠并定向移动,从而达到核酸与其它物质分离的目的。
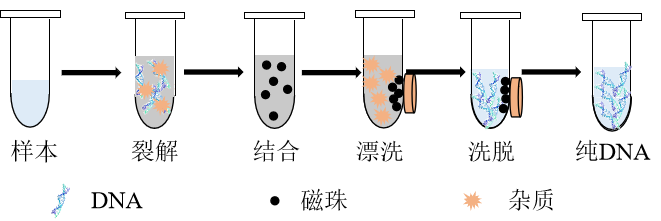
图3 磁珠法DNA提取过程示意图
三种纯化方法的比较:
| 纯化方法 | 沉淀法 | 离心柱法 | 磁珠法 |
|---|---|---|---|
| 优点 | 样本处理体积灵活、产量高 | 操作简便、快速,更安全,产物纯度高可用于下游实验 | 通量高,可实现自动化操作,产物纯度高 |
| 缺点 | 安全性低,无法进行高通量提取且纯度较低 | 存在堵住风险,对样本起始量有限制 | 需要搭配使用磁力架,成本相对较高 |
| 选择依据 | 时间充裕,样本量相对充足 | 操作简便、省时,提取出的DNA可应用于绝大多数下游实验 | 下游需要高纯度的DNA进行自动化提取 |
DNA提取基本原则
保证DNA结构的完整性
DNA结构的完整性会根据下游实验的目的而有所区别。如PCR、Southern杂交这一类实验基本保证所需片段的完整即可,二代测序实验为了获得全面的序列信息对DNA的完整性要求较高,三代测序则要求DNA片段的完整性比二代测序更高。
保证DNA的纯度
去除对下游实验中酶分子有抑制作用的有机溶剂和高浓度金属离子;
将蛋白质、多糖、多酚等生物大分子的污染降到最低;
去除RNA(如RNA对后续实验的影响)。
常见问题解决方案
Q1. DNA降解
(1) 选择新鲜样本,减少内源酶的作用;
(2) 样本初始量不要超过所用方法的初始量标准;
(3) 样本避免反复冻融;
(4) 选择合适的处理方式并进行充分的样本前处理;
(5) 前处理结束后在样本解冻前添加裂解液;
(6) 正确添加所需试剂种类及使用量,样本量增加时裂解液也需成倍增加;
(7) DNA产物进行分装保存,避免反复冻融且保存时间不宜太久。
Q2. DNA产量低
(1) 对提取样本中DNA含量水平有一定了解;
(2) 选择合适的前处理及裂解方式(如延长裂解和DNA沉淀的时间等),尽可能的将样本中的DNA完全释放出来;
(3) 使用柱式试剂盒对DNA产物洗脱的时候,要尽量覆盖整个吸附膜;进行二次洗脱也可增加产量。
Q3. DNA纯度低
▶ 初始样本过量易导致裂解也不完全;
▶ 样本应进行充分裂解,特别是对于一些比较复杂、含有较多杂质(多糖、多酚等)的样本需进行特殊处理;
▶ RNA残留:使用RNase对RNA进行处理,处理时间不宜太短或太长(10 min左右);
▶ 蛋白残留:使用蛋白变性剂或蛋白酶K;沉淀法分层吸取上清时注意不要吸到下层沉淀蛋白。






