药典无菌检查用培养基适用性检查记录 需要包含哪些内容?
发布时间:2024-07-11 浏览次数:3440
最近小编收到不少药品企业的咨询,询问培养基适用性检查记录表格该如何设计,应该包含哪些内容,小编今天就大家密切关切的这一问题,进行设计分享。本次设计充分考虑到检验员繁重的工作量问题,本着操作记录可追溯,书写去繁化简的原则,同时充分考虑到2025版培养基验收部分的变化,小试牛刀,先对无菌检查用培养基适用性表格进行了设计,设计仅代表个人思路,不具有权威性,如有不同意见,可以留言区参与讨论。
药典无菌检查法用培养基适用性检查记录
一、基本信息:

二、所用关键仪器设备:
三、 检验方法:
1、无菌性检查
每批培养基一般随机取不少于5支(瓶)部分培养基,置各培养基规定的温度培养14天,定期观察结果。——2025版《中国药典》1101公示稿
2、灵敏度检查
□ 硫乙醇酸盐流体培养基:取 mL的硫乙醇酸盐流体培养基7支,分别接种不大于100cfu的金黄色葡萄球菌、铜绿假单胞菌、生孢梭菌各2支,另一支不接种作为空白对照,于30~35℃培养3天,培养时段内,定期观察结果。
□ 胰酪大豆胨液体培养基:取 mL的胰酪大豆胨液体培养基7支,分别接种不大于100cfu的枯草芽孢杆菌、白色念珠菌、黑曲霉各2支,另一支不接种作为空白对照,与20~25℃培养,接种枯草芽孢杆菌的培养管不超过3天,接种白色念珠菌、黑曲霉的培养管5天,培养时段内,定期观察结果。
四、检验结果:
□ 培养基的无菌性检验【第 次】
培养温度: ℃,起始培养时间 年 月 日
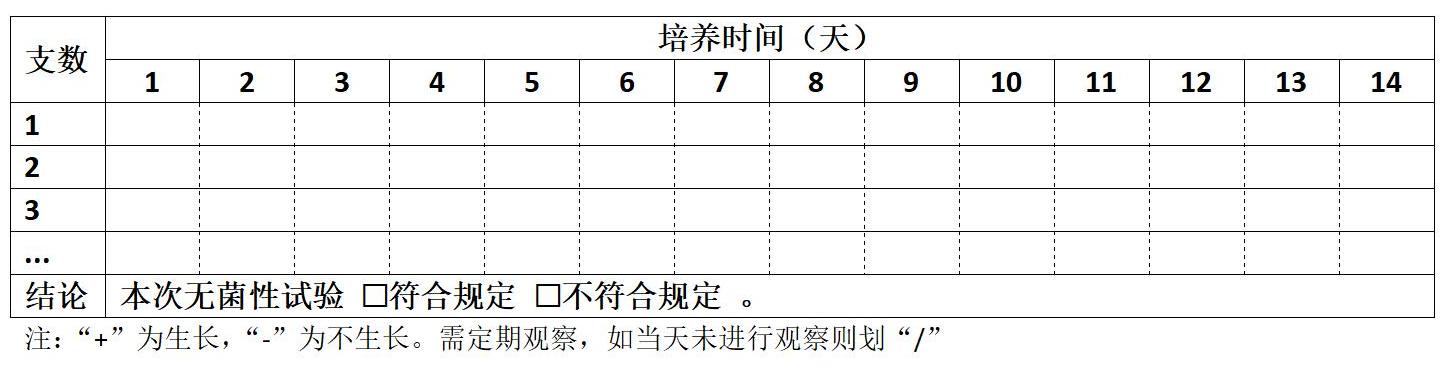
说明:2025版药典1101公示稿中,要求每批次培养基取部分培养,可在供试品检查时将培养基空白对照作为该批次培养基无菌性检查的组成部分。不局限于首次做5支培养。
□ 培养基的灵敏度检查

五、结论:
本品 (培养基名称) 批次(配制批次/成品试剂批次)按照 (标准名称)进行检验,结果 □ 符合规定 □ 不符合规定。
检验人: 检验时间: 复核人: 复核日期:






