从国内标准了解单增李斯特菌新型检测方法
发布时间:2024-09-04 浏览次数:3687
单核细胞增生李斯特氏菌(Listeria monocytogenes)简称单增李斯特菌,是一种人畜共患病的病原菌,感染会造成败血症、脑膜炎、胃肠炎等李斯特菌病,严重还会影响中枢神经系统甚至造成孕妇流产,被世界卫生组织定为四大食源性细菌之一,所以关于单增李斯特菌的检测与控制显得尤为重要。传统的单增李斯特菌检测方法(国标GB4789.30-2016 )包括增菌、分离、鉴定三部分(图一),整个定性过程大约需要1周时间。随着科学技术的发展与实际需求,越来越多灵敏、快速的单增李斯特菌检测方法被发现,不断有新技术被纳入国家标准/行业标准,例如:环介导恒温核酸扩增、微滴式数字PCR、实时荧光PCR、酶联免疫法、免疫磁珠法以及PCR-试纸条法。

图一:GB4789.30-2016
一、环介导恒温核酸扩增(SN/T5367.1—2022)
用环介导恒温核酸扩增(LAMP)技术进行单核细胞增生李斯特氏菌的筛选检测是根据单核细胞增生李斯特氏菌属特有靶序列上的6个独立区域,采用6条特异引物通过稳定的Bst DNA 聚合酶来驱动扩增反应,在60 ℃左右完成恒温扩增。在环介导恒温核酸扩增反应中,焦磷酸盐(PPi)通过ATP-硫酸化酶被转化成三磷酸腺苷(ATP)。荧光素酶利用ATP发光,从而实现实时检测。
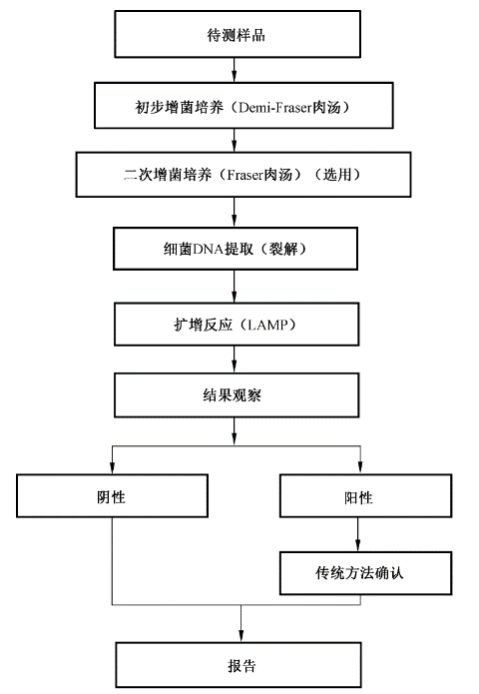
图二:SN/T5367.1—2022
二、微滴式数字PCR(SN/T5364.6—2021)
微滴式数字PCR是针对单核细胞增生李斯特氏菌溶血素(hly)基因片段设计引物、探针,将一定浓度的引物、探针与模板DNA 及数字PCR 反应预混液混合,配成PCR 反应体系。将该数字PCR 体系分布到10 000~20 000个微滴中,使大部分微滴中模板DNA 分子的数量为1或0,然后进行PCR扩增。hly 基因探针5’端标记FAM 荧光基团,利用数字PCR 系统的检测通道,可对每个微滴的荧光信号进行采集分析。含有模板DNA 的微滴出现荧光信号的增强,形成阳性微滴簇。根据阳性微滴的有无判定样品中是否含有单核细胞增生李斯特氏菌。
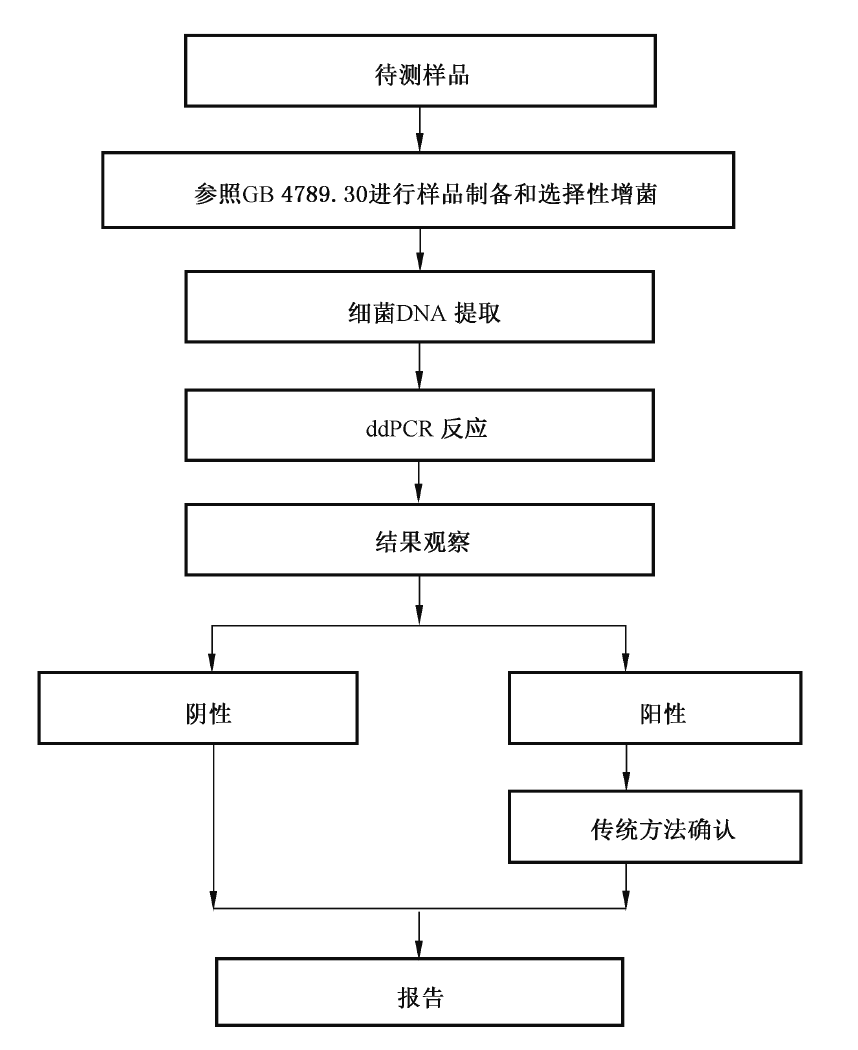
图三:SN/T5364.6—2021
三、酶联免疫法(GB/T22429-2008)
将做增菌处理后的增菌液经加热处理后移入包被特异性抗体(一抗)的固定容器中内,使目标菌与一抗结合,洗去未结合的其他成分后加入特异性酶标抗体(二抗),再次洗去未结合的其他成分,加入特定底物与之反应后可以生成荧光化合物或有色化合物,通过检测荧光强度或吸光度,与参照值比较即可得到检验结果。
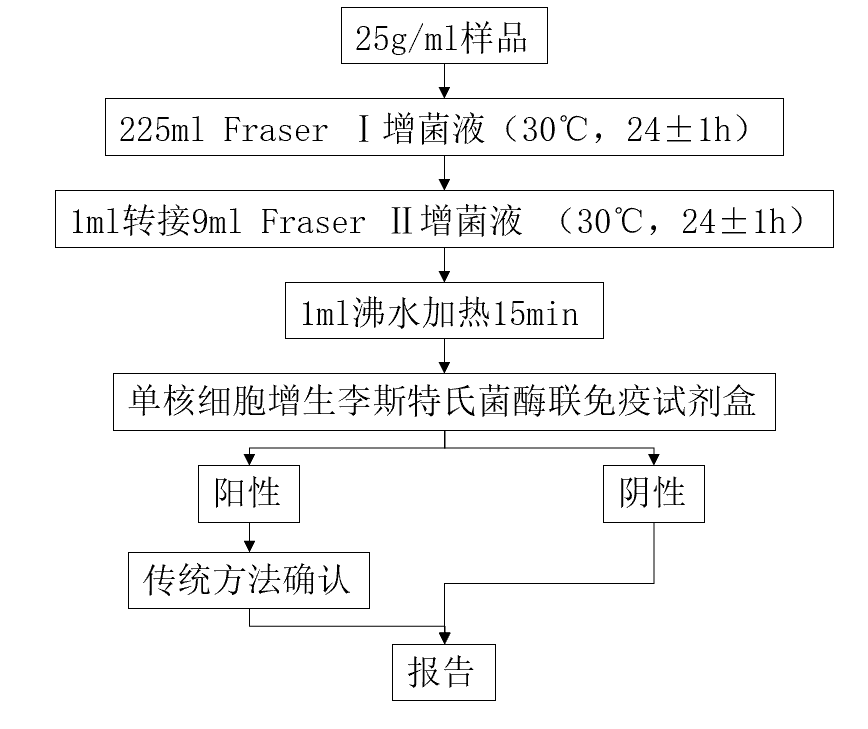
图四:GB/T22429-2008
四、免疫磁珠法(SN/T0184.3-2008)
免疫磁珠法是将直径0.05um~4um具有磁性的微珠的表面化学修饰,并与李斯特氏菌特异性抗体结合,制成免疫磁珠,它能与食品中李斯特氏菌抗原结合,从而检出食品中的李斯特氏菌。样品经24~48h增菌后,分别取1mL增菌液和20ul免疫磁珠加入带盖塑料管中,在磁板背景下混合,如果有李斯特氏菌抗原存在,免疫磁珠就会将其捕获,然后利用磁性将免疫磁珠聚集,经清洗后接种到显色培养基和任选一种培养基(OXA 或PALCAM琼脂),对于选择性分离平板上典型李斯特氏菌菌落进行确认,最终通过系列试验确定是否存在单核细胞增生李斯特氏菌。
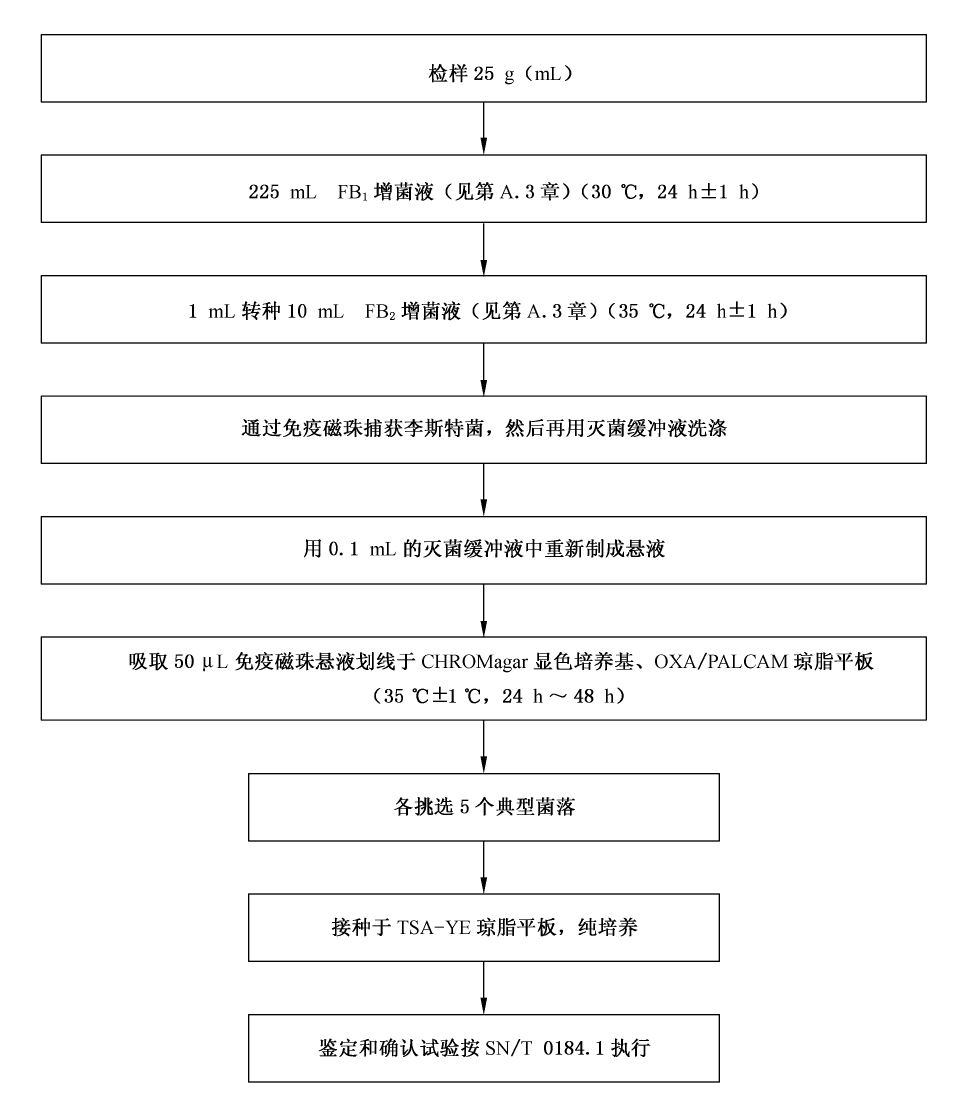
图五:SN/T0184.3-2008
五、PCR-试纸条法(SN/T5439.7—2022)
对样品中单核细胞增生李斯特氏菌进行增菌培养后提取DNA,采用上游和下游引物分别经地高辛和异硫氰酸盐标记的单核细胞增生李斯特氏菌的特异性检测引物进行PCR扩增。检测用试纸条上含有金标记的抗异硫氰酸盐的抗体,可与PCR产物上的异硫氰酸盐标记分子结合,在检测线位置上有抗地高辛抗体,可与PCR产物上的地高辛标记分子结合,从而显色。如模板未扩增,则无PCR 产物与地高辛抗体及FITC抗体结合,从而不能在检测线(T线)位置显示颜色。

图六:SN/T5439.7—2022
来源:微生物安全与健康网,作者~李颖






