粪大肠菌群酶底物法/纸片法 滤膜法 多管发酵法三种方法比对分析
发布时间:2025-06-20 浏览次数:1008
以下是对粪大肠菌群检测中酶底物法/纸片法 、纸片法、滤膜法和多管发酵法三种常用方法的详细比对分析,涵盖原理、操作、优缺点和应用场景。
核心目标: 检测水样(或其他样品)中是否存在粪大肠菌群,即能在44.5±0.5℃下发酵乳糖产酸产气的大肠菌群细菌。它们是粪便污染的指示菌。
1. 多管发酵法 (Multiple-Tube Fermentation Technique, MTF)
水质 粪大肠菌群的测定 多管发酵法(HJ 347.2-2018)

原理: 基于统计学概率(最大可能数 - MPN)。将不同体积的水样(或稀释液)接种到一系列含有乳糖蛋白胨培养液的发酵管中。经过初步发酵(产酸产气为阳性)、复发酵(确认试验)和耐热性试验(44.5℃培养)来证实粪大肠菌群的存在并估算其数量(MPN值)。
操作流程:
1,初发酵: 将不同体积的水样(如10mL, 1mL, 0.1mL)或稀释液接种到单料或双料乳糖蛋白胨发酵管中,35-37℃培养24±2小时。
2,观察产气: 观察发酵管产酸(溴甲酚紫指示剂变黄)和产气(杜氏小管内有气泡聚集)。记录阳性管数。
3,复发酵(证实试验): 将所有产酸产气的发酵管或仅阳性管转种到EC培养液或亮绿乳糖胆盐肉汤中。
4,耐热性试验: 将转种的EC管置于44.5±0.5℃水浴或培养箱中培养24±2小时。
5,结果判断: 观察EC管是否产气。产气者即为粪大肠菌群阳性。
6,结果计算: 根据初发酵阳性管(或经复发酵证实的阳性管)的组合,查MPN表得到每100mL水样中粪大肠菌群的最可能数(MPN/100mL)。
优点:
标准方法: 是许多国家和组织的标准方法,仲裁性强。
灵敏度相对较高: 尤其适合检测菌群密度较低的水样(如清洁水源)。
能处理浑浊或有色水样: 对样品的物理性状要求相对较低。
能估算活菌数量: 提供MPN值。
缺点:
操作繁琐: 步骤多(初发酵、复发酵、耐热性试验),耗时长(总培养时间约48-54小时)。
耗材量大: 需要大量玻璃器皿(发酵管、试管、吸管等)和培养基。
结果非精确计数: MPN是统计学估计值,置信区间较宽,精确度低于滤膜法。
主观性: 产气判断(尤其是少量气泡)可能存在主观性。
占用空间大: 培养和操作需要较大空间。
主要应用场景:
◑ 饮用水、水源水等水质标准的法定检测。
◑ 浑浊度较高、有颜色或有干扰物质的水样。
◑ 菌群密度较低的水样。
◑ 需要仲裁结果的场合。
2. 滤膜法 (Membrane Filtration Technique, MF)
水质 粪大肠菌群的测定 滤膜法(HJ 347.1-2018)

原理: 将一定体积的水样通过孔径为0.45μm的微孔滤膜过滤,细菌被截留在滤膜表面。将滤膜转移到选择性培养基(如M-FC培养基)上,在44.5±0.5℃下培养24±2小时。粪大肠菌群菌落呈蓝色(因发酵乳糖产酸使培养基中的苯胺蓝指示剂变蓝)。
操作流程:
1,样品准备: 水样可能需要稀释(若预期菌落过多)。
2,过滤: 在无菌条件下,将已知体积的水样(通常100mL或适量稀释液)通过无菌滤器中的无菌滤膜(0.45μm)进行抽滤。
3,转移滤膜: 用无菌镊子将截留有细菌的滤膜转移到吸饱M-FC培养基的衬垫上(或直接放在含M-FC培养基的平皿中)。
4,培养: 将平皿置于44.5±0.5℃的培养箱中培养24±2小时。
5,计数: 计数滤膜上生长的蓝色菌落(粪大肠菌群)。
6,结果计算: 根据过滤水样体积和计数的菌落数,计算每100mL水样中的粪大肠菌群数(CFU/100mL)。
优点:
快速: 总时间短(约24-26小时),能更快获得结果。
结果精确: 直接计数菌落形成单位,结果更直观、精确(CFU值),比MPN法离散度小。
可处理大体积水样: 能浓缩水样中的细菌,提高低浓度水样的检测灵敏度。
耗材相对较少: 主要耗材是滤膜和培养基。
可同时检测多个指标: 同一水样可过滤多张膜用于不同项目检测(如总大肠菌群、粪大肠菌群)。
缺点:
对水样要求高: 浑浊度高、悬浮物多、藻类多的水样会堵塞滤膜,影响过滤速度和准确性,必须先进行预处理(如絮凝沉淀)。
背景干扰: 某些非目标菌也可能生长或产生类似颜色,需要经验鉴别(M-FC选择性已较好,但仍需注意)。
设备投入: 需要真空泵、滤器、恒温水浴(精确控温44.5℃)等设备。
菌落重叠: 高浓度水样可能导致菌落重叠,影响计数准确性。
操作需规范: 过滤操作需严格无菌,转移滤膜需小心避免损伤。
主要应用场景:
◑ 相对清洁、低浊度的水样(如处理后的饮用水、地表水、地下水、游泳池水)。
◑ 需要快速获得精确计数结果的常规监测。大体积水样中低浓度细菌的检测。
3. 酶底物法/纸片法 (Defined Substrate Technology, DST / Enzyme Substrate Test, 常称纸片法)
水质 总大肠菌群、粪大肠菌群和大肠埃希氏菌的测定 酶底物法(HJ 1001-2018)

水质 总大肠菌群和粪大肠菌群的测定 纸片快速法(HJ 755-2015)

原理: 使用含有特定营养底物和指示剂的预制培养基片(纸片、小袋、小管或孔板)。粪大肠菌群特有的酶(主要是β-半乳糖苷酶和β-葡萄糖醛酸酶)能水解底物,释放出发色团或荧光团,使培养基产生特定的颜色变化(如由黄色变蓝绿、变红)或荧光。培养温度通常为35-37℃(检测总大肠菌群)或44.5℃(检测粪大肠菌群)。
操作流程 (以常见水样纸片为例):
1,加样: 用无菌吸管或注射器将规定体积(通常1mL或10mL)的水样加入含有预制干燥培养基的纸片袋(或小瓶/孔)中。,
2,封口/混合: 密封袋口(或盖紧盖子),充分混匀,确保水样浸润培养基。
3,培养: 将接种好的纸片袋(或小瓶/孔)置于恒温培养箱中培养。检测粪大肠菌群需在44.5±0.5℃培养24小时。
4,结果判读: 观察培养基颜色变化(或荧光)。根据说明书判断阳性(颜色变化/有荧光)或阴性(无颜色变化/无荧光)。阳性纸片袋/孔的数量可用于估算MPN值(查厂家提供的MPN表)或直接报告为“检出”/“未检出”(定性)。
优点:
操作极其简便: 步骤少(加样-培养-判读),无需配制大量培养基和灭菌大量器皿。
快速: 培养时间通常24小时。
便携性好: 试剂盒体积小、重量轻,特别适合现场快速筛查或资源有限地区。
不易受杂菌干扰: 选择性底物设计使其特异性较好,背景干扰少,结果判读相对客观(颜色变化明显)。
标准化: 商品化试剂质量稳定,减少人为操作误差。
废物少: 产生的固体废物较少。
缺点:
定量精度有限: 主要用于定性或半定量(MPN估计),精确度不如滤膜法(CFU计数)。
MPN表覆盖范围可能有限。
成本较高: 单位测试成本通常高于传统的多管发酵法和滤膜法(耗材成本)。
检测限: 通常只能检测1mL或10mL样品体积,对极低浓度水样的灵敏度不如能浓缩大体积的滤膜法。
对水样浊度/颜色敏感: 浑浊或有色的水样可能干扰颜色判读。
标准化依赖厂商: 方法性能高度依赖特定商品试剂盒,不同品牌可能有差异。
仲裁性: 在一些法规标准中可能不作为仲裁方法(但认可度在提高,如EPA已批准部分DST方法)。
主要应用场景:
◑ 现场快速检测和应急监测(如灾后、野外)。
◑ 中小型实验室或资源有限实验室的常规筛查。
◑ 食品、饮料等非水样中大肠菌群的快速检测(原理相同,培养基配方可能调整)。
◑ 需要简便操作和快速定性结果的场合。
三种方法关键特性对比总结表
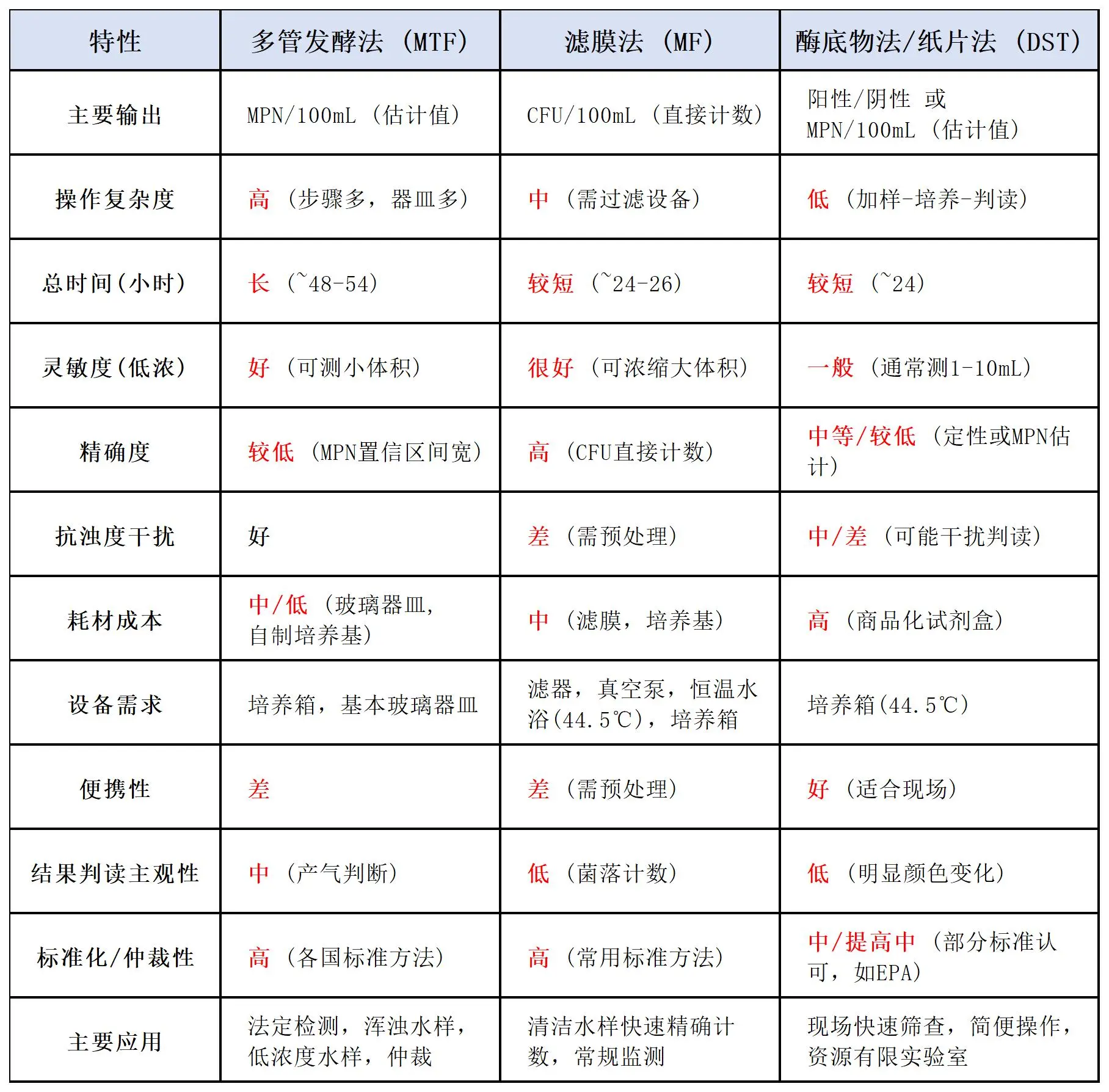
结论与选择建议:
1、追求法定性、仲裁性、处理复杂水样(浑浊/低浓度): 首选多管发酵法 (MTF)。
2、追求快速、精确计数结果(CFU),处理清洁/低浊度水样: 首选滤膜法 (MF)。
3、追求操作简便、快速筛查、现场检测、资源有限环境: 首选酶底物法/纸片法 (DST)。
在实际工作中,选择哪种方法取决于具体的检测目的(定性/定量/仲裁)、水样特性(浊度、预期菌浓度)、可用时间、实验室设备条件、成本预算以及相关法规或标准的要求。有时也会结合使用,例如用纸片法进行快速初筛,阳性样品再用MTF或MF法进行确认和定量。
本文由环凯转载自“环保季”公众号,版权归原作者所有,仅供学习参考,如有侵权请联系删除!