制药环境微生物监测怎么做?——国内外法规要求汇总
发布时间:2025-07-04 浏览次数:8
在药品生产过程中,医药企业对微生物的污染控制负主体责任,定期的环境微生物监测工作对生产环境的维护尤为关键,微生物监测包括环境浮游菌和沉降菌,关键的检测台面,人员操作服表面及5指手套等的微生物监测。除了微生物监测方法和监测标准等,本期主要结合国内外法规和指南为大家分享环境微生物的检测“频次”相关内容。
中国药典2020版9205指导原则
9205“药品洁净实验室微生物监测和控制指导原则”是药品洁净实验室对微生物监测和控制最重要的参考原则,同时也成为洁净厂房相关参数制订的首要依据,9205建议企业按照表4设置监测频次:
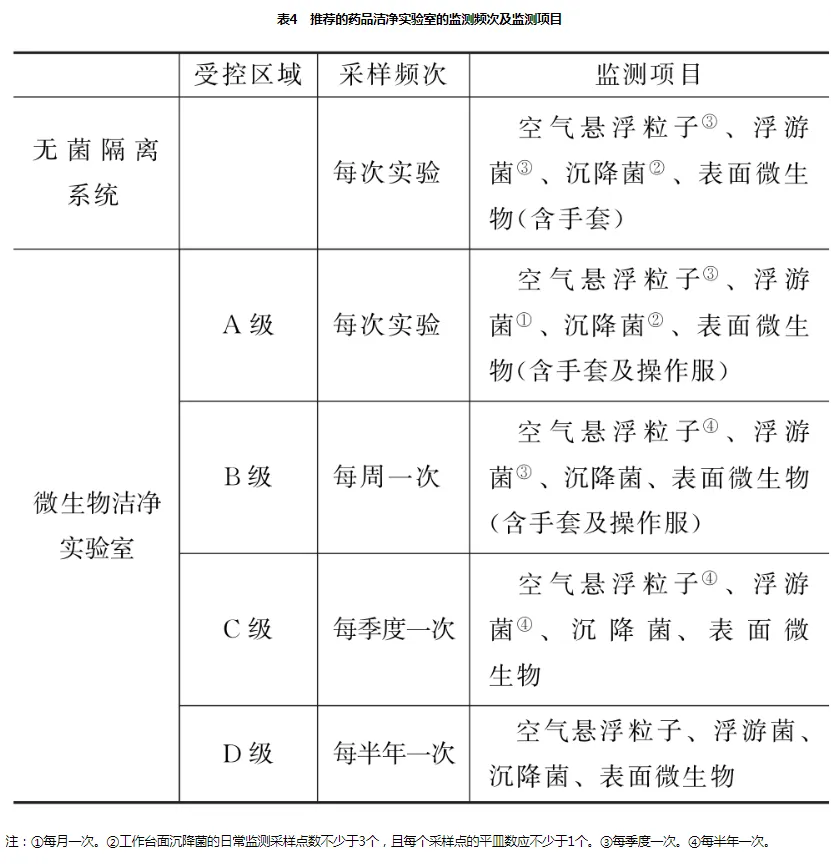
如果出现连续超过纠偏限和警戒限、关键区域内发现有污染微生物存在、空气净化系统进行任何重大的维修、消毒规程改变、设备有重大维修或增加、洁净室(区)结构或区域分布有重大变动、引起微生物污染的事故、日常操作记录反映出倾向性的数据时应重新评估监测程序的合理性。
药品GMP指南-质量控制实验室与物料系统
药品GMP指南在药品生产质量管理规范中起到重要指导意义,《药品GMP指南-质量控制实验室与物料系统》中,第13章“制药用水、气体及实验室环境、人员的质量监测”-13.4“实验室洁净区的环境监测”,建议微生物监测频次参照表13-6:

取样频次根据以下因素不同而不同:产品的种类及特性、设备/流程的设计、人员活动的多少、微生物环境监测的历史数据等。频次的设定应具体情况具体分析、监测频次设定的关键是要能反映系统的潜在风险。在以下情况,应增加环境取样频率:
♦ 环境监测数据有上升趋势时,应增加相应区域的监测位点频率;
♦ 安装新设备,改造现有设备时,可增加现有位点的频率;
♦ 增加操作人员或操作班次时,根据操作范围和时间增加位点和频率;
♦ 改变无菌操作技术;
♦ 无菌实验和环境监测超标时,要增加相应检验区域的环境监测频率。例如,当最终产品出现阳性结果时,实验室应当增加环境监测频率。
产品出现阳性结果时,实验室应当增加环境监测频率。
如果有历史数据表明监测结果比较稳定,也可适当减少频次。在减少频次之前,应回顾历史数据,并且经由质量保证人员复核并批准后方可执行。减少频次之后,应定期回顾,以确保该频次仍适用。
USP <1116> Microbiological Control and Monitoring of Aseptic Processing Environment 美国药典无菌工艺环境的微生物控制和监测
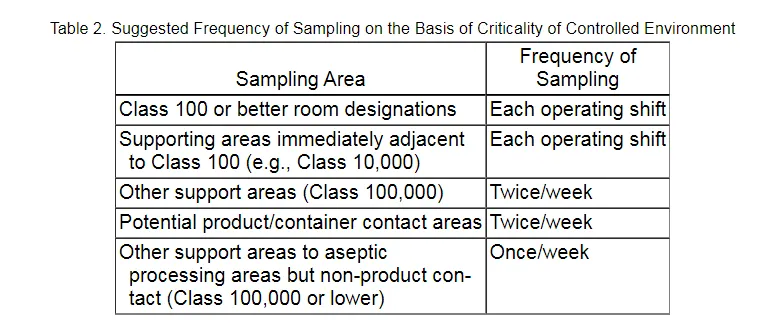
在USP <1116> Establishment of Sampling Plan and Sites制定取样方案和取样区域的章节中描述到:
Table 2 suggests frequencies of sampling in decreasing order of frequency and in relation to the criticality or product risk of the area being sampled. This table distinguishes between aseptic processing where personnel are aseptically gowned and those where a lesser gowning is appropriate. Environmental monitoring sampling plans should be flexible with respect to monitoring frequencies, and sample plan locations should be adjusted on the basis of the observed rate of contamination and ongoing risk analysis. On the basis of long-term observations, manufacturers may increase or decrease sampling at a given location or eliminate a sampling location altogether. Oversampling can be as deleterious to contamination control as undersampling, and careful consideration of risk and reduction of contamination sources can guide the sampling intensity.
表2根据取样区域的关键性或产品风险,按频率递减顺序列出了对应的取样频率。该表区分了人员需要穿无菌服的无菌工艺操作和需要穿较少无菌服的无菌工艺操作。环境监测采样计划在监测频率方面应具有灵活性,采样计划的位置应根据观察到的污染率和持续的风险分析进行调整。根据长期观察结果,制药企业可以增加或减少特定地点的采样,或完全取消某个采样位置。采样过多和采样不足一样,都会对污染控制产生不利影响,因此,仔细考虑风险和减少污染源可为采样强度提供指导。
EU Annex1 Manufacture of Sterile Products欧盟GMP附录1-《无菌药品生产》依据欧盟GMP附录1中的第9章节,环境监测应符合下列规定:
9.25 A risk assessment should evaluate the locations, type and frequency of personnel monitoring based on the activities performed and the proximity to critical zones. Monitoring should include sampling of personnel at periodic intervals during the process. Sampling of personnel should be performed in such a way that it will not compromise the process. Particular consideration should be given to monitoring personnel following involvement in critical interventions (at a minimum gloves, but may require monitoring of areas of gown as applicable to the process) and on each exit from the grade B cleanroom (gloves and gown). Where monitoring of gloves is performed after critical interventions, the outer gloves should be replaced prior to continuation of activity. Where monitoring of gowns is required after critical interventions, the gown should be replaced before further activity in the cleanroom.
风险评估应根据所执行的活动以及与关键区域的接近程度,对人员监测的位置、类型和频次进行评估。监测应包括在工艺过程中定期进行人员监测采样。人员监测采样应以不影响工艺过程的方式进行。对于人员监测,参与关键干预操作后(至少包括手套,但可能需要监测适用于工艺的洁净服区城)以及每次离开 B 级洁净室时(手套和洁净服),应特别考虑。如果在关键干预操作后监测手套,则应在继续活动之前更换外层手套。如果在关键干预操作后需要监测洁净服,则应在洁净室进一步活动之前更换洁净服
9.31 (c) It should be noted that for grade A, any growth should result in an investigation.
应注意,对于A级区,任何生长都需启动调查程序
9.31 Microorganisms detected in the grade A and grade B areas should be identified to species level and the potential impact of such microorganisms on product quality (for each batch implicated) and overall state of control should be evaluated. Consideration should also be given to the identification of microorganisms detected in grade C and D areas (for example where action limits or alert levels are exceeded) or following the isolation of organisms that may indicate a loss of control, deterioration in cleanliness or that may be difficult to control such as spore-forming microorganisms and moulds and at a sufficient frequency to maintain a current understanding of the typical flora of these areas.
应对A级和B级区检出的微生物进行鉴定,并应评估此类微生物对产品质量(涉及的每个批次)和整体受控状态的潜在影响。还应考虑对C级和D级区检出的微生物进行鉴定(例如,超出行动限或警戒水平),或在分离出可能表明失控、洁净度恶化的微生物或难以控制的微生物(例如可形成孢子的微生物和霉菌)后进行鉴定,并以足够的频率保持对这些区域的典型菌群的最新了解。
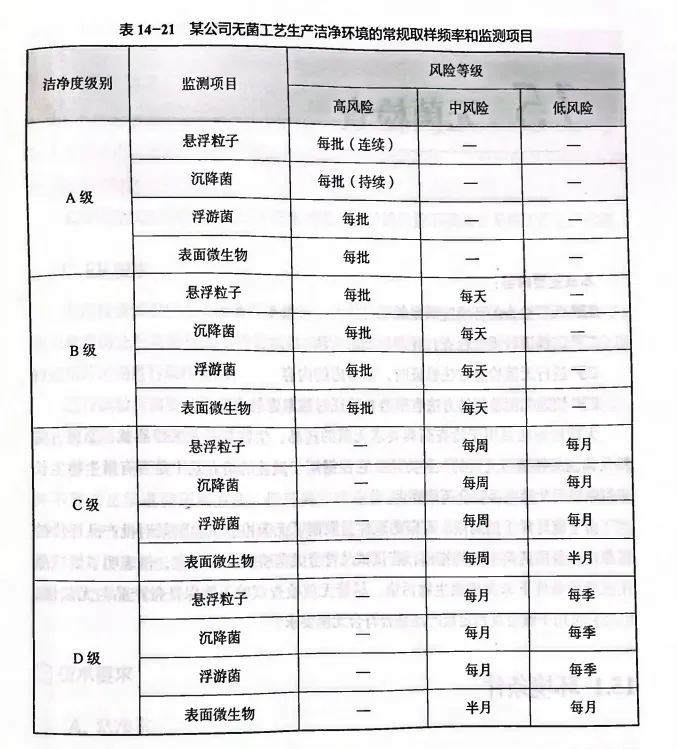
《药品GMP指南-无菌制剂》
在《药品GMP指南-无菌制剂》14.4环境监测风险评估章节-监测频率评估中提到,洁净区取样频率采用的是随区域重要性递减(如关键区域、关键区域的邻近区域、其他非邻近区域等)或随取样产品风险递减而渐减的原则,并在表14-21提供了实例分析:
综合上述法规和指南,有一部分关于取样频率的要求,但还有一些工艺流程的监测频率,在各个工厂里会有很大差异,这取决于对风险的分析。这些分析包括但不限于:生产工艺或产品的类型、设施或工艺的设计、人为干预因素的数量、是否使用最终灭菌(包括无菌测试放行、参数放行)和微生物环境的历史数据。没有任何一个单一的取样方案适用于所有环境。
同时,随着季节的变化,微生物的检出数量可能会发生变化,设计出来的取样频率计划应以能发现这些变化,进而持续改善。选择监测频率的一个关键目标是能够识别潜在的对产品造成污染风险的系统缺陷。频率改变后,需要定期复核数据以证明改变的取样频率是否仍旧合理。
参考资料
[1] 国家药典委员会.中华人民共和国药典2020年版第四部,9205《药品洁净室实验室微生物监测和控制指导原则》. 北京:中国医药科技出版社, 2020
[2] 国家药品监督管理局食品药品审核查验中心. 药品GMP指南-质量控制实验室与物料系统. 北京:中国医药科技出版社,2023.
[3] USP Microbiological Control and Monitoring of Aseptic Processing Environments
[4] EU Annex1 Manufacture of Sterile Products
[5] 国家药品监督管理局食品药品审核查验中心. 药品GMP指南-无菌制剂. 北京:中国医药科技出版社,2023.
本文由环凯转载自“浙江天科”GZH,版权归原作者~所有,仅供学习参考,如有侵权请联系删除!











