微生物检测技术新突破!让“DP”引领微生物研究新潮流!
发布时间:2025-07-29 浏览次数:355 分享:
研究背景
众所周知,微生物检测传统方法流程繁琐、耗时长,传统平板培养虽是微生物学实验室 “黄金标准”,但存在劳动强度大、孵育时间长(18 - 72小时)、单细胞分辨率有限等问题,无法满足快速诊断与高效分析需求。自动化微生物培养机器人系统虽能减少人力投入,但未解决孵育时间长和复杂群落单细胞分离困难等根本问题。而现行的微流控技术虽有优势,但也存在局限,如液滴微流控技术易出现液滴融合、长期培养物质交换受限、设备昂贵复杂等问题;微室基微流控技术则存在难以回收检测细菌、调整生长条件灵活度低等挑战。

研究方法
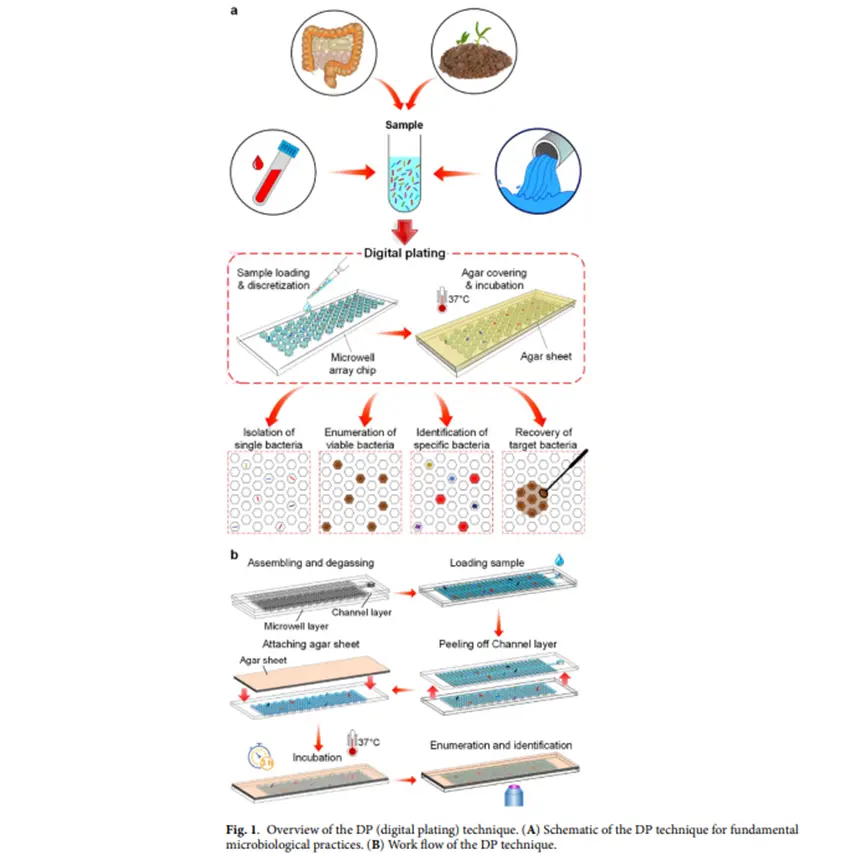
数字平板(DP)平台构建:核心部件是高密度皮升微井阵列芯片,通过预脱气诱导真空将细菌悬浮液分配到微井中,再覆盖特制营养 / 化学物质琼脂片。利用琼脂片可更换性,灵活改变微井培养微环境。
微井阵列芯片制作:采用软光刻技术制作PDMS PicoArray芯片,包含113137个六边形微井。先在硅片上制作通道层和微井层模具,再将PDMS倒模、固化、脱模并与通道层对齐接触形成可逆密封。
覆盖琼脂片制备:将LB肉汤粉、琼脂粉溶解于水,按需添加试剂后倒入PDMS腔室模具,覆盖塑料片、玻璃片及重物,室温固化后取出琼脂片。
细菌悬浮液制备:实验使用多种细菌,从甘油冻存管复苏后,经液体培养基培养、琼脂平板培养等步骤,最终用生理盐水稀释至所需浓度。
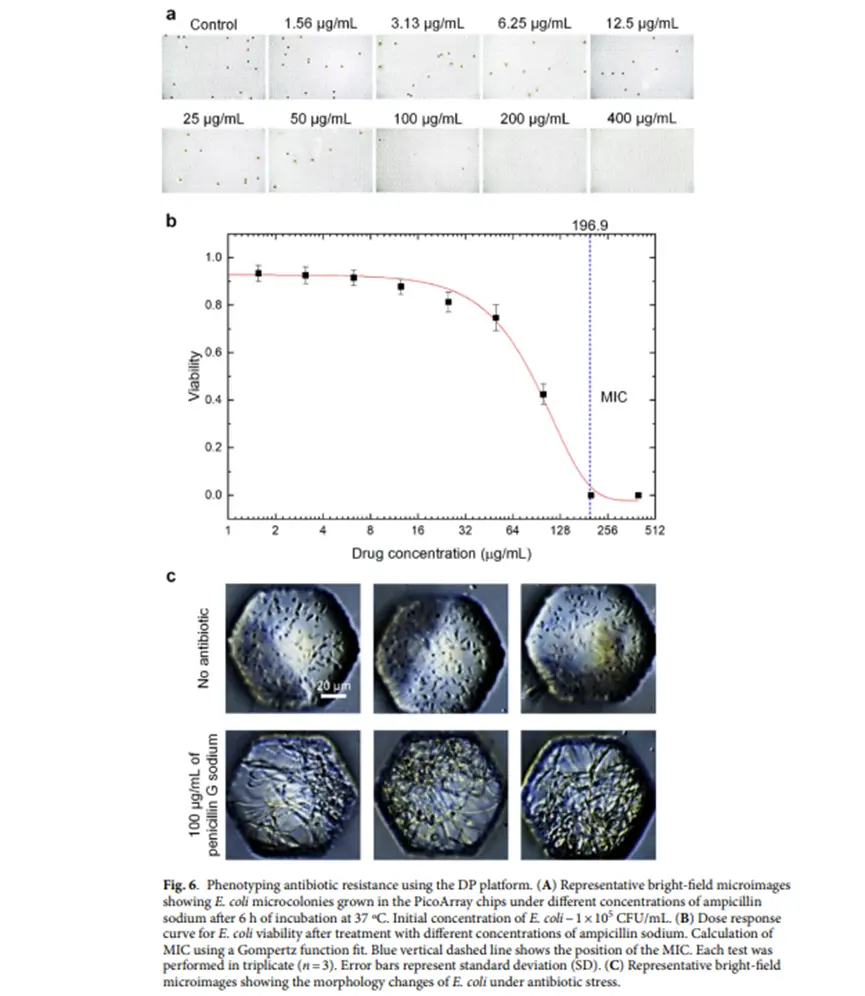
抗生素药敏试验(AST):以氨苄西林钠为模型抗生素,用其水溶液制备不同浓度梯度的琼脂片,覆盖于含有大肠杆菌的PicoArray芯片上,孵育后观察细菌生长情况,评估药敏性。
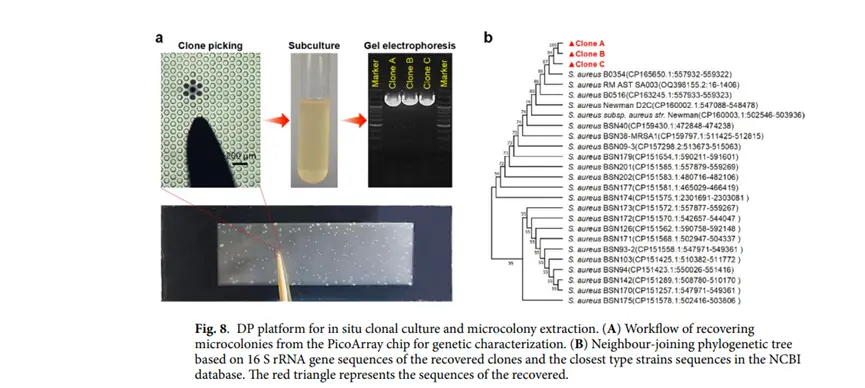
16S rRNA基因PCR扩增与测序:用MiniBEST细菌基因组DNA提取试剂盒从回收的微菌落中提取基因组DNA,用通用细菌引物对16S rRNA基因进行PCR扩增,送样测序后用 BLAST比对序列构建系统发育树。
图像与数据分析:用荧光显微镜获取明场和荧光图像,ImageJ 软件识别计数微菌落,定量数据以均值 ± 标准差表示,用单因素方差分析(ANOVA)和 Tukey 检验进行统计分析。
研究结果
平台概念与流程验证(图1):DP 技术可将细菌悬浮液分配到微井中,覆盖琼脂片后孵育,通过显微镜观察微菌落形成,实现微生物检测与分析,整个流程具备用户友好、快速、精准等诸多优势,为微生物检测提供新策略。
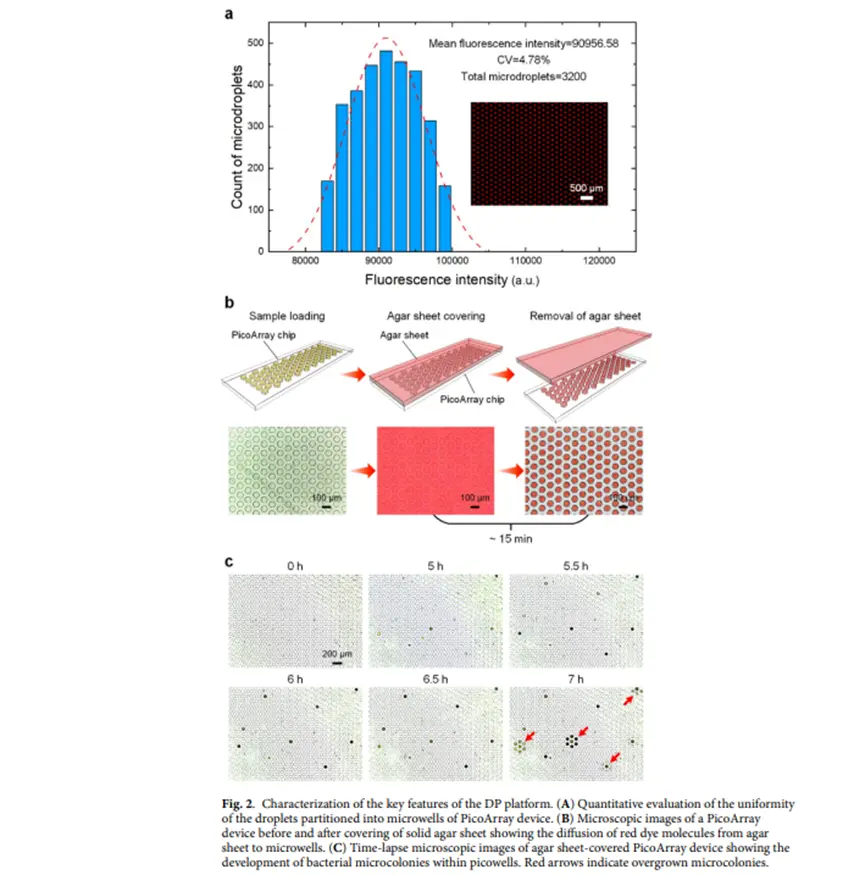
微井阵列均一性评估(图2-a):通过分析 Rhodamine B 液滴的荧光强度,3200 个随机液滴的总荧光强度变异系数(CV)约为 4.78%,表明 PicoArray 芯片与自分离机制结合可实现高度均匀的数字化微生物检测样本分配。营养物质扩散验证(图2-b):将含红色染料的琼脂片覆盖于 PicoArray 芯片上,15分钟后移除,芯片所有微井溶液变红,证实琼脂片中的分子能有效均匀扩散至微井,利于微生物培养微环境调节。细菌计数时间点确定(图2-c):以大肠杆菌为例,发现培养6小时时微菌落清晰可辨且独立,7小时后出现过度生长,故计数应在6 - 7小时内完成,不同微生物因生长速率差异,最佳计数时间不同。
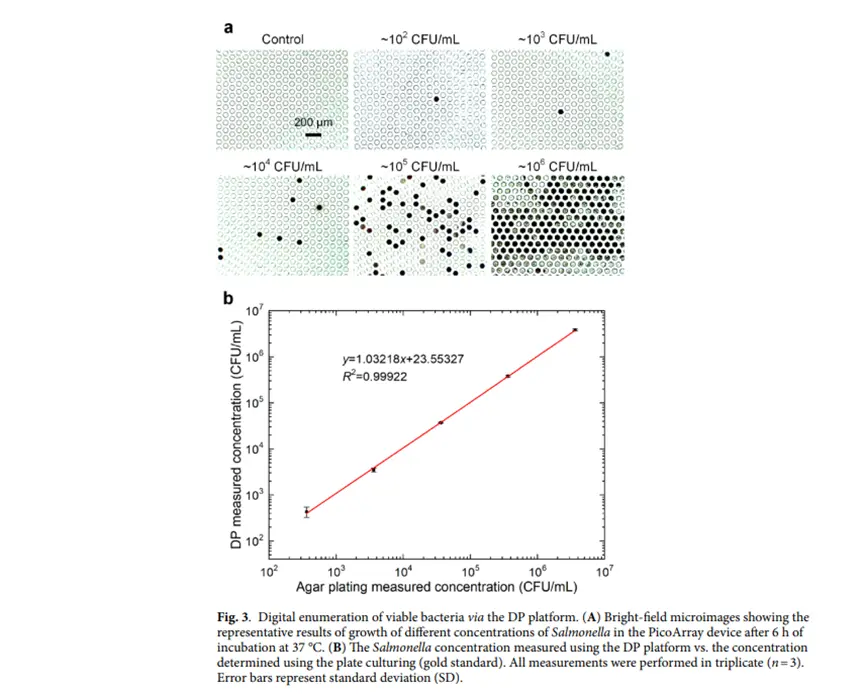
细菌快速准确计数能力展示:将不同浓度沙门氏菌样本加载到芯片上,6小时后显微镜下计数,其数字CFU方法(图3)测得浓度与传统平板计数法结果高度一致(R²= 0.9992),且仅用时6小时,远快于传统方法。
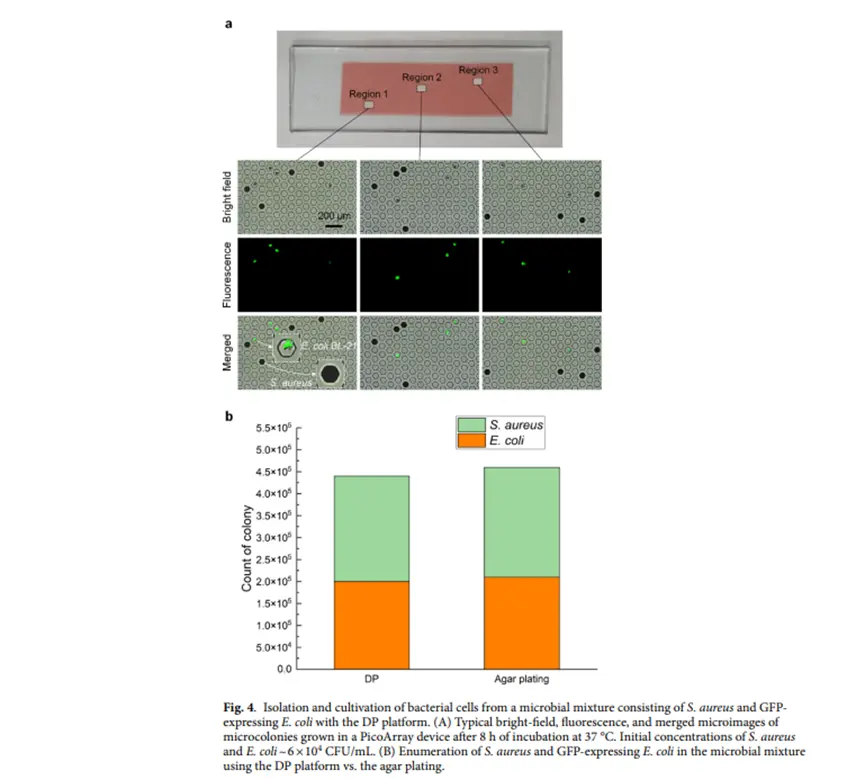
单一细菌分离培养能力验证:DP平台从由金黄色葡萄球菌和 GFP(绿色荧光蛋白)标记的大肠杆菌组成的微生物混合物中分离和培养细菌细胞的能力。图片(图4-a)显示了在37°C 孵育8小时后,PicoArray 装置中生长的微菌落的典型明场、荧光和合并显微图像,突出了金黄色葡萄球菌和GFP标记大肠杆菌微菌落的独特形态。图片(图4-b)呈现了使用DP平台与传统琼脂平板方法对微生物混合物中细菌进行计数的结果对比,证明了DP平台在混合群落中准确定量细菌的潜力。
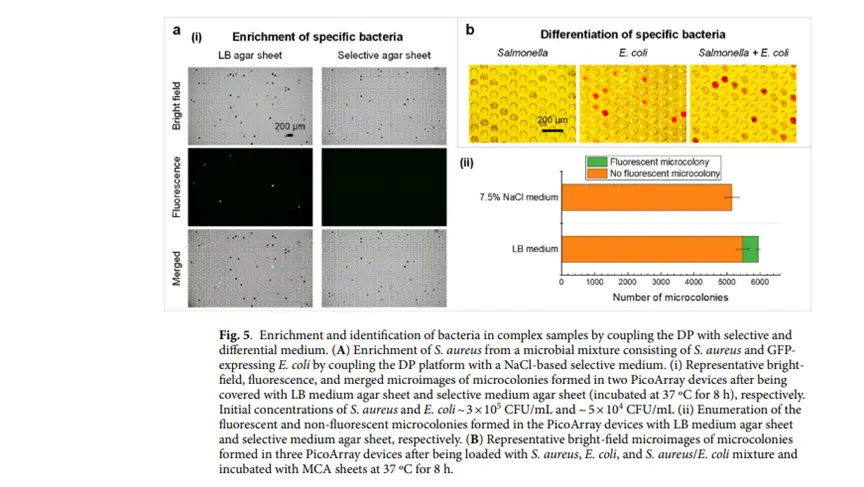
特定细菌富集与鉴定:通过与选择性培养基和差异培养基联用,DP平台可从混合菌群中富集特定细菌并鉴定。如用含7.5% NaCl的选择性培养基调制DP芯片,成功抑制大肠杆菌生长,富集金黄色葡萄球菌;用麦康凯琼脂差异培养基区分大肠杆菌和金黄色葡萄球菌。
使用DP平台对细菌进行抗生素抗性表型分析的情况:图片部分(图6-a)显示了在不同浓度氨苄西林钠条件下,37°C 孵育6小时后,PicoArray 芯片中生长的大肠杆菌微菌落的代表性明场显微图像,初始大肠杆菌浓度约为1×10⁵ CFU/mL。图片部分(图6-b)展示了大肠杆菌在不同浓度氨苄西林钠处理后的剂量反应曲线,通过 Gompertz 函数拟合计算最小抑菌浓度(MIC),蓝色垂直虚线指示MIC的位置,每个测试重复三次(n=3),误差条表示标准差(SD)。图片部分(图6-c)部分显示了大肠杆菌在抗生素胁迫下形态变化的代表性明场显微图像。
DP平台与选择性培养基调制芯片富集金黄色葡萄球菌以及与差异培养基调制芯片区分不同细菌的情况:DP平台与选择性培养基和差异培养基联用,可从混合菌群中富集特定细菌并鉴定,如富集金黄色葡萄球菌、区分大肠杆菌和金黄色葡萄球菌,为研究特定微生物在复杂群落中的作用提供手段。
快速表型药敏试验:以大肠杆菌和氨苄西林钠为例,不同浓度氨苄西林钠的琼脂片覆盖芯片,孵育后观察到含抗生素微井中细菌生长受抑制,随着氨苄西林钠浓度增加,含微菌落的微井数量减少,计算得出最小抑菌浓度(MIC)值与肉汤微量稀释法结果接近,且DP平台试剂消耗少、速度快、可实现单细胞分辨率的耐药性异质性定量表型分析。对临床合理用药具有重要意义。
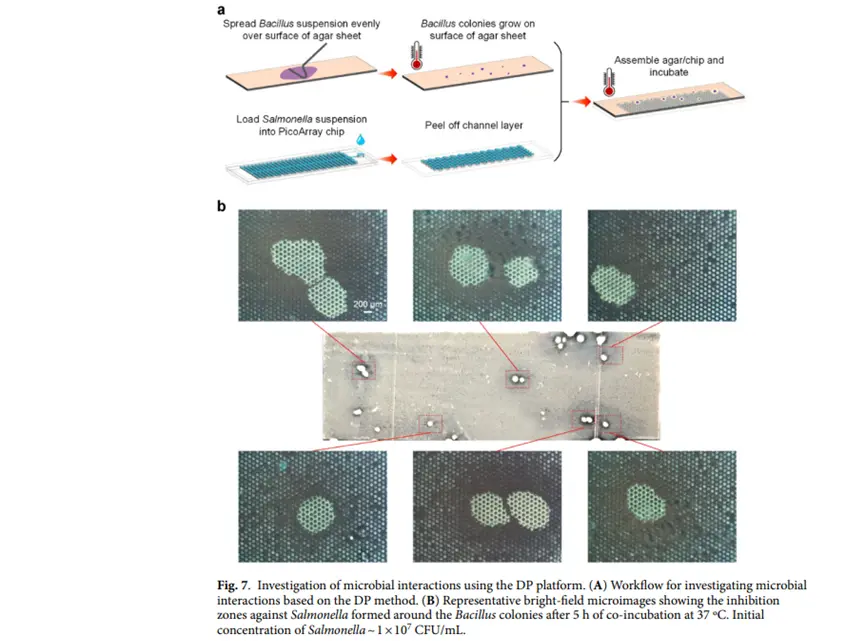
研究与展望
该数字平板平台技术为微生物学研究与应用开辟了广阔前景。在临床诊断方面,其快速、准确的细菌定量和药敏试验能力,有望大幅缩短感染性疾病诊断时间,助力精准医疗,改善患者预后。例如,在医院感染控制中,能更迅速地鉴定病原体并确定抗生素敏感性,减少经验性治疗的盲目性,降低耐药菌产生风险。在环境微生物学领域,该平台能够从复杂微生物群落中高效分离单一细菌,有助于发现新物种、研究微生物群落结构与功能,以及探索环境微生物在生态系统中的作用。比如在土壤、海洋等环境样本研究中,深入理解微生物相互作用和代谢过程,为环境保护和生态修复提供依据。合成生物学方面,可利用其高通量、单细胞分辨率优势,筛选和优化微生物菌株,提高生物合成效率,加速新型生物材料和生物能源的研发。
文献链接:10.1038/S41598-025-11525-6
来源:微生物安全与健康网,作者~吴文卿。











