图文解说细胞传代要点及注意事项
发布时间:2022-05-27 浏览次数:4195
传代培养几乎是所有细胞生物学实验的基础。当细胞在培养瓶中长到一定密度都会因为接触抑制而停止生长,之后就需要将其稀释分种成多瓶,细胞才能继续生长。这一过程就叫传代。传代培养可获得大量细胞供实验所需,但培养皿中的细胞很容易受到外界污染,培养液是营养富集的液体,可以支持细胞在其中生长,然而,水能载舟亦能覆舟,“好喝”的营养液,使得细菌们也能在培养液中快乐生长,同时离体培养的细胞也是各类病毒、支原体等的大爱,因此,需要周全保护细胞“宝宝”们,以下所有操作要在严格的无菌条件下进行,每一步都需要认真仔细的无菌操作。
细胞生长一般经历4个时期:潜伏期、对数生长期、平台期和衰亡期【1】。其中对数生长期指细胞呈指数(2n)增长。处于对数生长期的细胞生长最快,细胞活力最强,是进行实验的最佳时间。
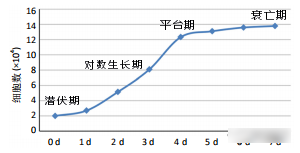
细胞接触抑制是正常细胞生长增殖的关键特性,被认为是调节细胞增殖的关键机制,这种机制可以有效地防止细胞增殖失控。在培养细胞时,正常细胞在高密度情况下发生接触抑制现象,使细胞周期停滞在G0/G1期,从而形成单层细胞【2】。因此我们在细胞发生接触抑制前需要将细胞传代来扩大细胞数量。
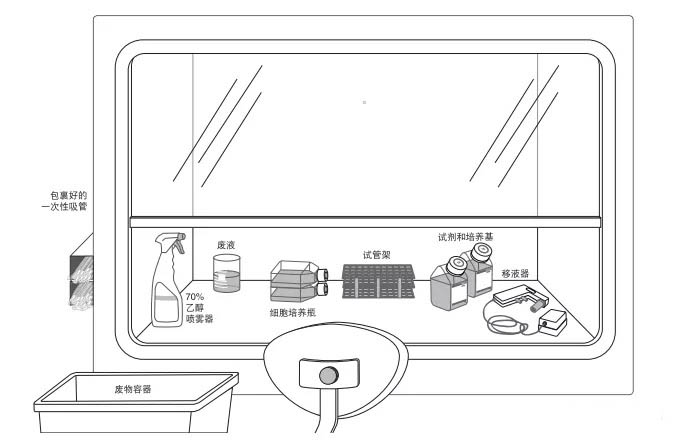
材料和器材
材料:培养瓶/皿,离心管,移液管,移液器,废液缸,75%酒精,所需培养细胞。
药品:DMEM培养基,小牛血清或胎牛血清,0.25%胰蛋白酶,PBS缓冲液,青链霉素双抗。
仪器:CO₂培养箱,倒置显微镜,超净台。
实验步骤
细胞传代图解:
【预热含10%血清的DMEM培养基、PBS、0.25%胰酶】

Tips:作为热源的金属珠浴,要留意定期消毒哦~
【从培养箱拿出细胞,镜下观察细胞状态,并判断是否达到了可传代的密度】

【回到超净台中,吸去培养基,加入PBS,晃一晃,润洗一遍】
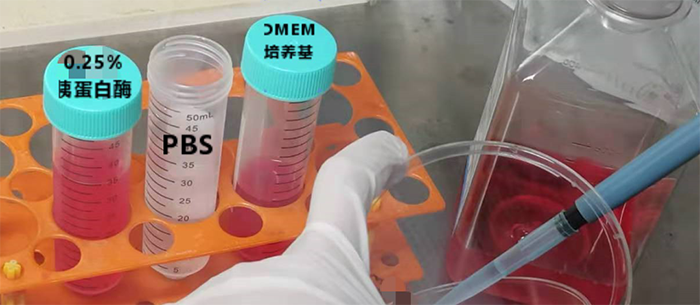
可重复以上动作,用PBS再次清洗,防止残留培养液中的血清影响胰酶效果。
【吸去PBS,加入0.25%胰酶】

【放入37℃培养箱,开始消化并计时】
【1-2min后,用含10%血清的DMEM培养基终止,通过吹打使细胞脱离培养皿底部,最后将细胞悬液转移至离心管】
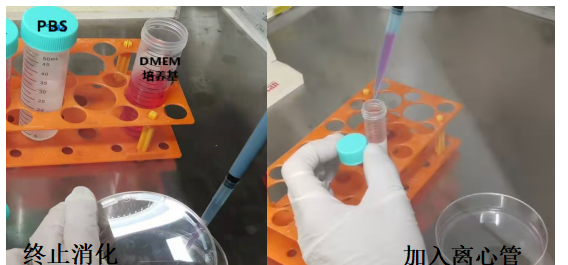
【500 rpm细胞离心3min】

【弃上清,加DMEM培养基重悬】
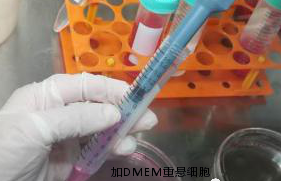
【将细胞悬液加入培养皿中】
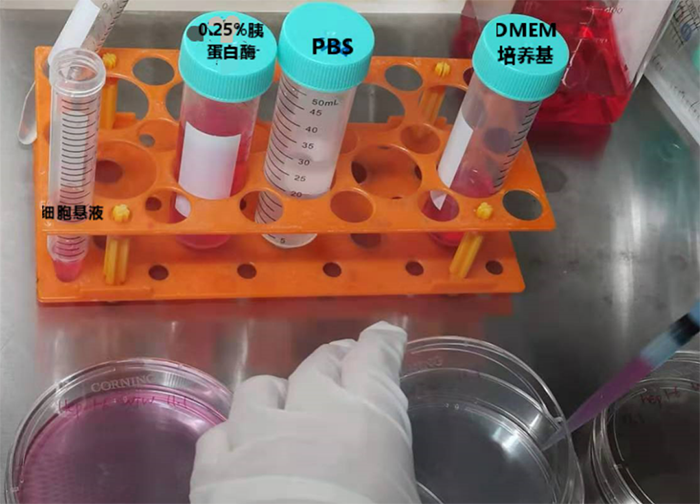
具体操作及tips:
无菌操作规范:在实验开始前,需要将超净台紫外照射灭菌(至少20min),我们需要穿好灭菌服,戴好灭菌手套和口罩。


准备工作:将PBS,胰酶,含10%血清的DMEM培养基置于37℃下预热。灭菌离心管,枪头提前放入超净台照射紫外。
所有物品从外面移入超净台都需要喷洒75%酒精消毒,并且同样用75%酒精消毒双手。
① 从培养箱取出细胞培养皿(一般选择处于对数期的细胞),倒置显微镜下观察细胞形态和细胞密度,确定细胞是否需要传代及细胞需要稀释的倍数。

② 用酒精喷壶在培养皿表面喷洒75%酒精消毒,转移培养皿到超净台,打开盖子(注意酒精不要喷太多,打开盖子也要小心,不要让酒精误进入皿内),轻轻吸出旧的培养液,加入适量PBS润洗细胞1-2次(注意从侧壁加入,以免冲掉细胞),弃去PBS缓冲液。
Tips:这一步的目的是要去除培养基中血清对胰酶消化细胞的影响哟~
③ 用移液器加入0.25%胰酶(Trypsin)于培养皿中(能够铺满皿底即可,具体量根据实验需要确定,过多或过少都不利实验),置于37℃培养箱中消化1-2分钟。
④ 将加入胰酶的细胞培养皿转移到倒置显微镜载物台,镜下观察细胞消化情况。对于贴壁牢的细胞,可用手指尖轻轻拍打培养皿底部,促使其脱落。待细胞大部分变圆并脱落,准备终止消化,加1-2倍体积的含10%血清培养基终止消化。
胰酶消化与血清终止原理小课堂:
细胞外含有多种胞外蛋白,如胶原蛋白以及糖蛋白,使细胞间或细胞与培养瓶内壁粘连起来,而胰蛋白酶能够催化蛋白质的特定肽键(赖氨酸或精氨酸的羧基所构成的肽键)水解从而使得细胞从培养皿上脱落下来。而EDTA主要是通过螯合钙镁离子,钙镁离子是保持细胞间相互连接所必需的,所以没有钙镁离子,贴壁细胞之间的连接就被打开了。
所以终止时我们所加的培养基中含有钙镁离子和胎牛血清,都是胰酶抑制剂,血清终止的原理其实是竞争抑制,就是用过量的血清含有的蛋白来和胰酶结合,从而不给胰酶消化细胞外蛋白的机会。
Tips:这一步要把握好时间,切勿消化过度,及时终止消化。如果消化不够充分可以轻拍培养皿帮助细胞脱落,转移进超净台也别忘了酒精消毒哟~
⑤ 用1ml移液枪轻轻吹打混匀,使细胞脱离培养皿底部,将混合细胞悬液转移至离心管中(离心管规格根据实验需要确定),配平,500-800rpm离心3-5分钟左右。
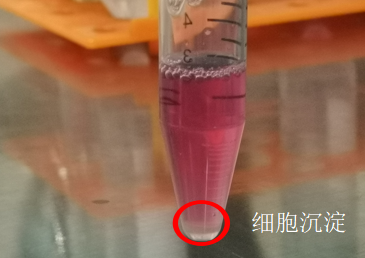
⑥ 离心好后,轻轻取出离心管。
Tips:此时可以看到细胞在管底形成肉眼可见的细胞团块,团块大小与细胞多少有关,拿取过程中小心不要发生碰撞,把管底的细胞团块撞散,影响得率。
用酒精喷壶喷洒离心管表面,转移进超净台,打开盖子,将上清液小心倒入废液缸,加入10%血清培养基,用移液器轻轻吹打,制成细胞悬液。这就是待接种的种子啦~
Tips:弃上清的动作需一次完成,切忌抬起管口,让液体流回底部后,又再次倾倒。回流的液体会把细胞团块冲散甚至冲起来,再倾倒有把细胞团块倒掉的风险。
⑦ 根据细胞生长特性,将细胞悬液按1:2-1:5的比例分到新的培养皿中,八字手势晃匀后,置于倒置显微镜载物台,观察细胞情况。细胞喜欢扎堆,传代接种应保证一定数量,数量太少“胞二代”们会长不起来哟。
Tips:原代脂肪细胞可以少批次的传代,因其较永生化细胞更脆弱,传代密度适当提高,更有利于其生长哦。
⑧ 在培养皿上做标记,注明传代时间,细胞种类,操作人员等信息。在放入培养箱之前应再次用酒精喷一喷培养皿表面,放入培养箱后,把培养皿内的细胞再次晃动使其铺板均匀,防止生长密度不一,最后关上培养箱的门。
⑨ 传代完成啦,记得整理操作台,用75%酒精擦拭超净台台面,清理废液和垃圾,最后打开超净台内的紫外灯。
⑩ 在细胞传代前如果培养基有变黄迹象,吸去培养基,加入新鲜的含10%血清的DMEM培养基。
Tips:培养基的红色是酚红试剂的颜色,酚红试剂是一种pH指示剂,中性时为红色,碱性时为紫色,酸性时为黄色。细胞生长繁殖会消耗培养基的营养物质,分泌代谢产物,如果细胞生长旺盛,代谢活跃,产生大量乳酸和CO₂。在细胞培养48h后,培养液由红变黄说明营养物质消耗掉了,该换培养基了,此时也可以查看一下细胞密度,是否就需要传代啦~另外如果有支原体污染,也会使培养基发黄,但细胞会在几周后死亡。因此大家需要每天check好细胞状态哟~
参考文献:
【1】Eagle H et al. Nature. 1967.
【2】Abercrombie M et al. Nature. 1979






