hPSCs细胞来源的肠类器官培养方案
发布时间:2023-07-21 浏览次数:873
肠上皮是成年哺乳动物中自我更新最快的组织,平均自我更新时间少于5天。肠干细胞位于肠隐窝(intestinal crypt)底部附近,每个隐窝中的干细胞大约有4-6个,它们产生快速增殖的转运扩增(TA)细胞,肠细胞、杯状细胞和肠内分泌细胞都从TA细胞发育而来。TA细胞快速分裂、转运扩增的子细胞占据了隐窝的其余部分,并流向绒毛的侧面,在那里它们分化、吸收营养,最终在绒毛尖端凋亡【1】。
在体外可以由hPSCs来模拟胚胎肠发育的过程,通过添加高浓度的FGF4和Wnt3A,促使hPSCs衍生的终内胚层(DE)向中肠和后肠内胚层分化,并促进肠管样形态发生,进而产生包含吸收性肠细胞以及主要分泌谱系(包括Paneth细胞、杯状细胞和肠内分泌细胞)的肠类器官。本篇文章基于Nature protocols【2】整理了hPSCs细胞来源的肠类器官培养方案。
细胞来源:hPSCs
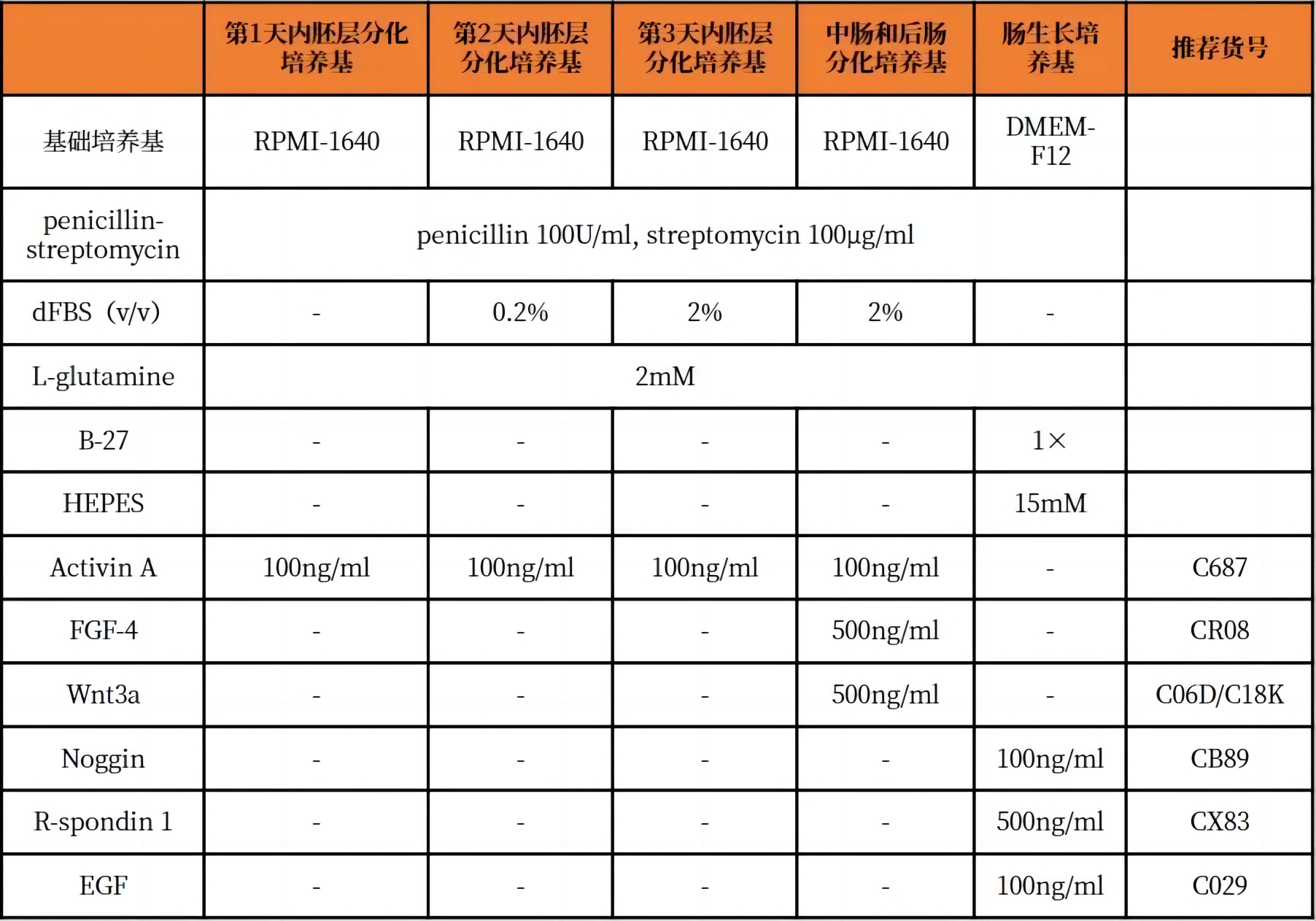
培养基配方
hPSCs培养和传代
1,将冻存的Matrigel在4°C下过夜解冻,在6孔板的每孔滴加1ml冷的Matrigel,旋动6孔板使Matrigel溶液分布均匀。随后转移至37℃条件下孵育10min使其凝固,使用前需室温静置1h。
2,将hPSCs接种在包被Matrigel的6孔板中,每孔加入3ml mTeSR1,放置在37℃,5%CO2的培养箱中,培养至细胞融合度约为75–85%、且大部分无分化的状态时,吸出培养基。
3,向hPSCs中加入1 ml Dispase(1mg/ml),并将培养皿放置在37℃条件下进行解离,直到所有的细胞都以小细胞块或单细胞的形式漂浮。向每个孔中加入5ml的DMEM-F12,以充分稀释Dispase。
4,将所有细胞转移至离心管中,室温下300g离心3min,收集沉淀细胞。加入DMEM-F12培养基,以1:6的比例接种在Matrigel包被的24孔培养板中,向每个孔中加入0.5ml预热的mTeSR1进行培养,在2-4天内细胞汇合度达到85-90%。
hPSCs分化成DE
5,吸出mTeSR1,向每个孔中加入0.5 ml预热的第1天内胚层分化培养基,并将平板放回37℃,5%CO2的培养箱中。
6,24h后,吸出第1天内胚层分化培养基,替换为每孔0.5ml预热的第2天内胚层分化培养基,并将平板放回37℃,5%CO2的培养箱中。
7,24h后,吸出第2天内胚层分化培养基,替换为每孔0.5ml预热的第3天内胚层分化培养基,并将平板放回37℃,5%CO2的培养箱中。
8,24h后,吸出第3天内胚层分化培养基,用不含Activin A的第3天内胚层分化培养基洗涤细胞一次。此时在显微镜下观察细胞,应该存在扁平的DE组织,该组织包含非常少的3D结构。
DE分化为中肠和后肠
9,从24孔培养板中吸出培养基,每孔滴加0.5 ml预热的中肠和后肠分化培养基。每24h更换一次新鲜中肠和后肠分化培养基,直至96h 。
10,在立体显微镜下,可以看到明显的3D结构。使用200μl移液器吸头从每个孔中收集球状体,并将大约50个球状体集中到1.5ml微量离心管中。
中肠和后肠球状体生长成人肠类器官
11,收集球状体后,将微量离心管垂直放置在管架上10min,此时球体通过重力沉降到离心管底部。吸出上清,控制总体积在25μl左右。
12,将冻存的Matrigel在4℃下过夜解冻,添加B-27补充剂(终浓度1×)、R-spondin1(终浓度500ng/ml),Noggin(终浓度100ng/ml)和EGF(终浓度100ng/ml),用移液器吹打混匀,配制成肠基质胶。
13,将球状体滴加在预冷的肠基质胶中,并将样品混匀,总体积将达到75μl(50μl基质胶+ 25μl培养基+球状体)。
14,将混合物接种在4孔板中,注意需接种在孔的中心,避免接触侧壁。
15,将4孔板放入37℃,5%CO2的培养箱中孵育10min,使Matrigel固化。
16,向每个孔中缓慢滴加0.5ml肠道生长培养基,确保基质胶被完全覆盖。
17,每隔4天,或当培养基中的酚红变黄时,更换肠生长培养基。
肠类器官传代
18,在第14天左右,通过将肠类器官重新包埋在新鲜的Matrigel中,来实现传代。
19,在显微镜下观察类器官,吸出孔内的培养基,加入少量DMEM-F12培养基。
20,使用200μl移液器吸头用力上下吹打Matrigel 3-5次,释放Matrigel中的类器官。
21,在37℃,5%CO2的培养箱中培养组织14天,每4天更换一次肠道生长培养基。
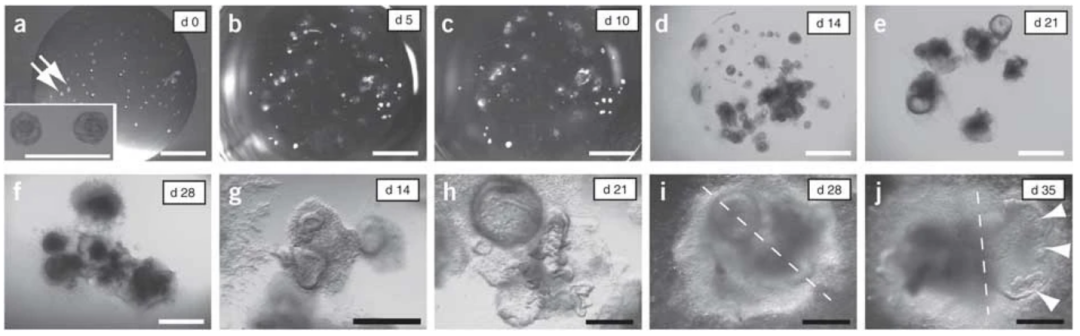
图1. 人肠类器官的培养过程【2】
肠类器官的最新应用进展
肠道类器官可以在体内移植,作为再生医学的临床前工具。2022年2月日本学者Satoshi Watanabe等人【3】利用右旋糖酐硫酸钠给药,在结肠远端引发上皮损伤,随后将肠道类器官原位移植到受体小鼠的结肠中,实现了上皮细胞的重建。这一步骤可在10分钟内完成,为肠类器官治疗溃疡性结肠炎的临床试验奠定了基础。
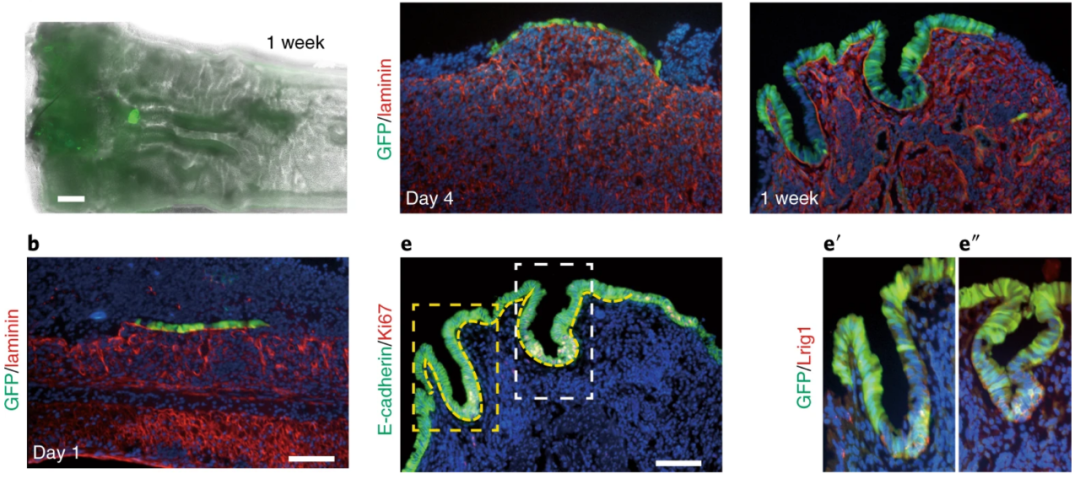
图2. 肠类器官(绿色)在移植1周后,成功整合到小鼠上皮损伤的区域【3】
类器官作为一种研究模型,在发育生物学、疾病病理学、细胞生物学、再生机制、精准医疗以及药物毒性和药效试验等方面潜力巨大。但是,类器官培养技术建立过程中会面临多种挑战。
参考文献
【1】SATO, Toshiro, et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature, 2009, 459.7244: 262-265.
【2】MCCRACKEN, Kyle W., et al. Generating human intestinal tissue from pluripotent stem cells in vitro. Nature protocols, 2011, 6.12: 1920-1928.
【3】WATANABE, Satoshi, et al. Transplantation of intestinal organoids into a mouse model of colitis. Nature Protocols, 2022, 1-25.
来源:“近岸蛋白 ”公众号,作者,Novoprotein。
说明:转载只为分享目的,如有侵权请联系删除,谢谢!






