一种实现鱼类过敏原快速检测的直接快速qPCR
发布时间:2024-09-02 浏览次数:665
识别肉类和食品中的动物物种对于维持食品安全和质量非常重要,特别是对于没有或不正确标记的动物物种,可能导致食物过敏反应,甚至危及生命。严格避免含有过敏原的食物是最有效的方法。
食品中鱼类过敏原的快速检测对食品安全至关重要,为了确保食品中鱼源成分的真实性,人们开发了多种检测鱼类的方法,包括显微镜观察、免疫学方法、红外光谱和色谱分析。镜观察有一个低检测限,并取决于检查员的经验和肉组织的完整性。疫方法灵敏、简便,但在食品加工过程中,蛋白质的三级结构很容易被破坏,从而影响检测。红外光谱技术对不同的食物种类需要不同的模型,需要大量的工作,且有一定的局限性。色谱分析根据产物中蛋白质、多肽和氨基酸的种类来源,可以检测到不同的种类,由于产品中蛋白质含量变化范围广,干扰因素多,色谱分析灵敏度低,容易出现假阳性。与其他检测技术相比,基于DNA检测的PCR技术具有特异性高、灵敏度高、不受食品种类限制等优点,已成为食品中物种检测的主流技术。然而之前的检测方法存在一些挑战,如样品提取繁琐、耗时。鉴于现有方法的局限性,作者提出了一种新的直接快速qPCR技术,以便快速、准确地检测食品中的鱼类过敏原。
本文作者对鱼类物种及其对应的Genbank编号进行分析。基于真核18S rDNA基因保守区设计引物和探针。使用NCBI BLAST工具评估引物和探针序列的特异性。优化qPCR条件,建立反应体系。分析来自不同物种样本的特异性和添加不同浓度鱼类到其他肉类混合物的敏感性。在真实食品样本中进行精密度测试。采用优化的核酸释放剂提取新鲜鱼、虾、牛肉、蟹、羊肉、猪肉、狗、鹅、鸡和鸭的总DNA,并进行快速定量PCR检测。结果显示,只有鱼类样品呈现典型的阳性扩增曲线,而其他动物源性物种和空白对照(ddH2O)均为阴性(图1),说明直接快速qPCR对鱼类具有特异性,不会与其他被测动物物种发生交叉反应。
确定快速qPCR条件,包括使用10μL的多探针qPCR混合物、特定浓度的引物和探针、模板DNA和循环的反应程序。通过不同比例添加鱼类到肉类混合物来评估敏感性。分析含鱼的实际食品样本进行精密度测试。通过与传统核酸提取方法相比较,验证肉类DNA提取的核酸释放剂的有效性。
优化的直接快速qPCR条件包括62℃的退火温度和0.25μM的探针浓度。直接快速qPCR具有检测0.00001%鱼类成分的高精确度。在真实食品样本中,中度阳性和弱阳性样本的直接快速qPCR方法展示了低于2%的CV值。实验结果显示直接快速qPCR方法对于检测食品样本中的鱼类成分具有高精确度,所有含有鱼的商业样本均呈阳性。
本实验在qPCR中采用了UNG酶抗污染方案,从根本上消除了PCR扩增子导致的假阳性结果,保证了检测的准确性。在操作步骤和报告等待时间方面,本研究与先前报道的鱼源成分qPCR检测技术相比具有显著优势(图2)。作为一种新型的快速现场核酸检测方法,在食品中鱼类过敏原的快速现场检测中具有广阔的应用前景。
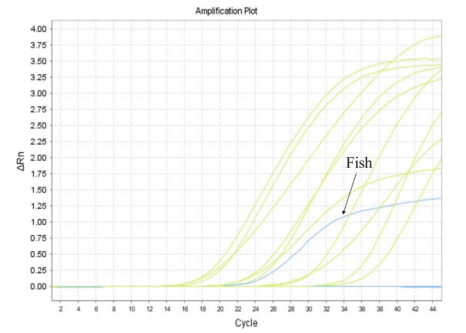
图1
直接快速qPCR检测特异性。蓝色s型扩增曲线为鱼的检测结果,蓝色直线为虾、牛肉、螃蟹、羊肉、猪肉、狗、鹅、鸡、鸭及阴性对照的阴性结果。黄色s型曲线为内参基因的扩增结果。
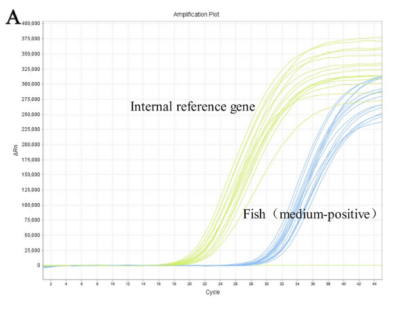
图2直接快速qPCR的灵敏度。
来源:微生物安全与健康网,作者~魏文杰






