RPA-CRISPR/Cas12a技术在大肠杆菌O157:H7现场快速检测中的应用
发布时间:2025-04-25 浏览次数:1135 分享:
RPA-CRISPR/Cas12a技术的优势
RPA(重组酶聚合酶扩增)是一种等温扩增技术,能够在37℃至42℃的恒温条件下快速扩增DNA,具有操作简便、快速高效的特点。CRISPR/Cas12a系统则是一种基于CRISPR技术的基因编辑工具,能够特异性地识别并切割目标DNA序列。将RPA与CRISPR/Cas12a结合,不仅能够实现快速的DNA扩增,还能通过CRISPR/Cas12a的特异性识别能力,提高检测的准确性和灵敏度。
在最新研究中,研究人员通过优化RPA反应条件和CRISPR/Cas12a检测参数,包括引物设计、crRNA浓度和转切割时间等,成功将检测的视觉下限降低到10¹ CFU/g,比现有方法提高了10倍。这一技术不仅能够快速检测大肠杆菌O157:H7,还能有效抵抗食品基质中的PCR抑制剂,确保检测结果的可靠性。
注射器滤膜的创新应用
为了进一步提高检测的灵敏度,研究人员引入了注射器滤膜技术。通过将样本溶液通过注射器滤膜过滤,能够快速浓缩目标细菌,显著提高检测效率。实验结果表明,注射器滤膜能够在短短5分钟内将大肠杆菌O157:H7的浓度提高25倍,极大地缩短了检测时间。
注射器滤膜技术的优势在于其便携性和操作简便性。与传统的真空泵过滤设备相比,注射器滤膜无需复杂的设备和电源支持,适合在各种现场环境中使用。此外,注射器滤膜的浓缩效果显著,能够在短时间内将低浓度的大肠杆菌O157:H7浓缩到可检测水平,为快速检测提供了有力支持。
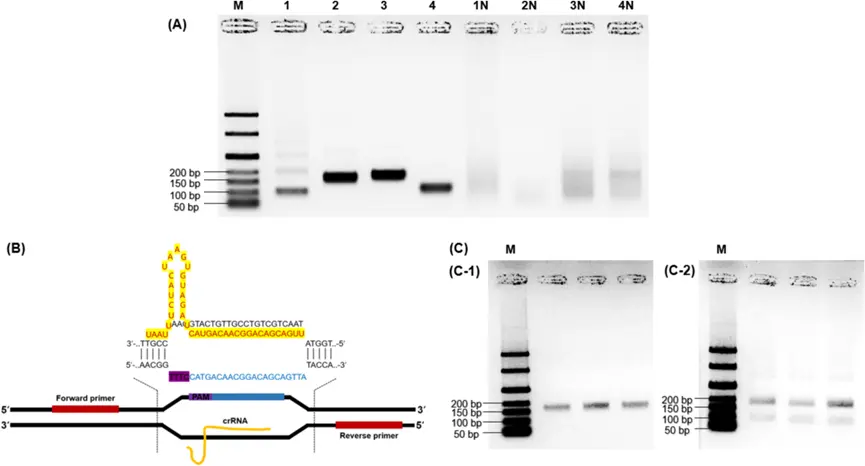
图1基于重组酶聚合酶扩增(RPA)的CRISPR/Cas12a系统的序列设计。筛选RPA引物(A):第1行:泳道1 - 4展示了使用引物组1 - 5扩增的阳性对照,泳道1N - 4N描绘了使用引物组1 - 5扩增的非模板对照(NTC)。(B)crRNA设计,(C)CRISPR/Cas12a介导的RPA产物顺式切割,(C - 1)RPA产物未切割,(C - 2)CRISPR/Cas12a对来自线性化靶双链DNA的RPA产物进行CRISPR/Cas12a介导的顺式切割。M:50 bp分子量标记。
实验验证与结果
研究人员通过在生菜样本中人工接种大肠杆菌O157:H7,验证了RPA-CRISPR/Cas12a结合注射器滤膜技术的检测效果。实验结果表明,该技术能够在55分钟内完成从样本处理到检测结果的全过程,检测下限低至10¹ CFU/g,远低于传统qPCR方法的10² CFU/g。即使在样本中含有PCR抑制剂的情况下,RPA-CRISPR/Cas12a技术依然能够准确检测出大肠杆菌O157:H7的存在,而qPCR则因抑制剂的影响而无法检测到高浓度的目标细菌。
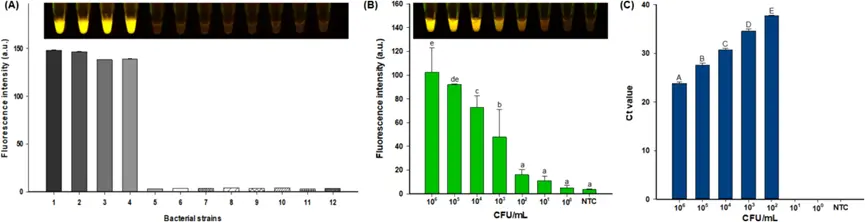
图2. RPA - CRISPR/Cas12a系统的评估。(A) RPA - CRISPR/Cas12a的特异性;泳道1 - 4:大肠杆菌O157:H7(美国典型培养物保藏中心编号43895、43889、35150和43890),泳道5 - 12:非大肠杆菌O157:H7(大肠杆菌、粪肠球菌、阪崎克罗诺杆菌、肠炎沙门氏菌、鼠伤寒沙门氏菌、金黄色葡萄球菌、单核细胞增生李斯特菌和铜绿假单胞菌)。(B) RPA - CRISPR/Cas12a在纯培养物中的灵敏度,以及(C) 实时PCR的Ct值。NTC,非模板对照。不同小写字母表示相对荧光强度存在显著差异(P<0.05),不同大写字母表示Ct值存在显著差异(P<0.05)。
未来展望
本研究基于RPA-CRISPR/Cas12a和注射器滤膜的检测技术具有快速、灵敏、便携的特点使其非常适合用于现场快速检测,能够有效防止食源性疾病的传播。未来,研究人员计划将该技术应用于更多种类的食品样本中,进一步验证其在实际检测中的适用性和可靠性。
参考文献:Lee S Y, Oh S W. Rapid and visual detection of Escherichia coli O157: H7 using an RPA-CRISPR/Cas12a-based syringe filter[J]. Microchemical Journal, 2025, 208: 112624.
来源:微生物安全与健康网,作者~蔡伟程。






