ddRFC:一种可扩展的多重液滴数字化核酸扩增检测平台
发布时间:2024-07-31 浏览次数:401
数字化核酸扩增检测(Digital nucleic acid amplification tests,dNAATs)因其高灵敏度和高特异性,已成为一种流行的核酸检测工具。然而,现有的大多数dNAATs平台都依托于“单色单靶标”的检测策略,这样的方法面临着光谱重叠的问题,且靶标检测重数受限于观测设备的荧光通道数目。为扩展dNNATs的多重检测能力,约翰霍普金斯大学的Tza-Huei Wang团队开发了一个多重液滴数字化核酸扩增检测平台,名为ddRFC(Droplet Digital Ratiometric Fluorescence Coding),该研究成果于2020年发表在《Biosensors and Bioelectronics》上。
dNAATs是一种在大量体积为fL到μL的反应单元中定量目标核酸分子的绝对定量方法。基于微流控发展的dNAATs具有下列优势:1)试样量消耗少;2)灵敏度高。相较于基于毫升体积的NAATs,微小的反应单元大大增加了目标分子的局部浓度,降低了体系中存在的反应抑制剂和多重反应体系中存在的竞争底物的干扰效应,由此提高了整体的检测灵敏度和特异性。也正因为此,dNAATs越来越多地应用于病原鉴定,遗传疾病筛查和癌症诊断等领域。然而,目前大多数dNAATs平台都存在多重检测能力不足以满足感染性疾病“多靶标齐筛选”的问题。这些平台大多基于“单色单靶标”的检测策略,这使得方法的多路复用能力受限于检测设备可用的荧光通道的数量(≤6)。然而,为了避免光谱重叠问题,并考虑到成本造价,大多数商用的dNAATs设备,例如BioRad ddPCR™和QuantStudio™ (Thermo Fisher)仅有2个荧光通道。为扩展dNAATs的多重检测能力,已有科研人员提出用荧光强度编码目标核酸来避免“单色单靶标”面临的挑战,尽管此方案可以在现有的2色检测器的范围内工作,但这种策略需要大量实验来优化引物/探针集的浓度,以平衡扩增效率、特异性以及竞争动力学。基于此研究背景,Tza-Huei Wang课题组提出了一个液滴数字化荧光比率编码(ddRFC)的多重dNAATs策略,反应原理可以概括为:通过在靶标特异性锁式探针上结合不同比率的两种颜色的分子信标,将其作为待检靶标的编码,形成液滴后进行HRCA反应,观测每个液滴的双色荧光信号强度,实现相应目标分子的多重定量。
研究所用的锁式探针包括3个部分:与靶标序列互补的2个末端;荧光编码区域(分子信标结合位点)以及HRCA通用引物结合位点。作者设计了6种靶标特异性锁式探针(仅使用2个不同荧光基团的分子信标),分别用于6种性传播病毒的检测:MG,HSV,NG,HIV,TP,CT,其对应的R/G编码分别为:0:1;1:4;1:1;2:1;4:1;1:0。其实验流程可以概述为:①将6种线型锁式探针和待检DNA混合样本于55℃下孵育1h;②探针与对应靶标结合后,线型则会转变成环状。向反应体系中加入HRCA通用引物和分子信标混合后形成3 pL液滴,收集于离心管中并于60℃孵育2 h,进行HRCA反应。随后95℃,5 min使酶失活,37℃ 20min使得分子信标结合到锁式探针结合位点上。③液滴注入检测通道,通过设计的系统测定荧光强度,MATLAB处理数据(图1)。
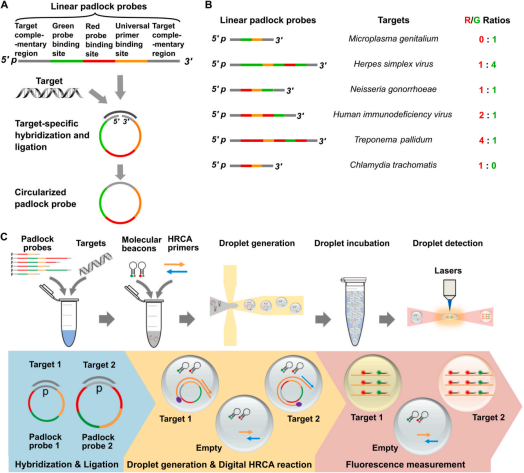
图1 ddRFC检测6种性传播病毒的设计原理(A-B)和实验流程(C)
作者首先利用合成的6种病毒的寡核苷酸进行了单重能力验证,结果显示液滴的相对荧光强度与设定的R/G值具有很好的相关性(图2A)。作者也绘制了每种设定R/G值下的阳性液滴的红色和绿色荧光强度的二维散点图,如图2B,可以观察到6个分离良好的种群,且测得的R/G值与设定值存在良好的线性关系(图2C),由此证明了方法的可行性。随后,作者展开了二重、四重乃至六重实验,根据所得的散点图,证明了方法的多重检测能力(图3)。
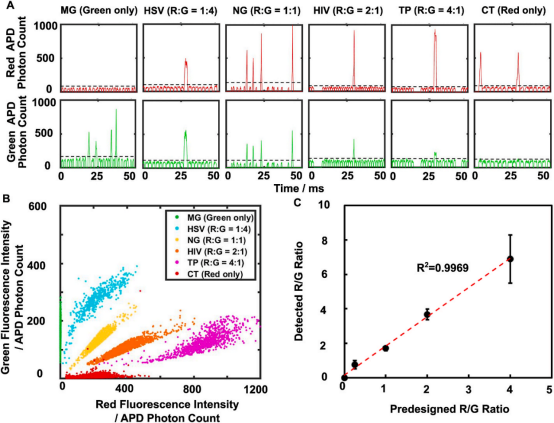
图2 (A)LIF系统记录的每个液滴的红色和绿色荧光时间轨迹;(B)6个样本的红色和绿色荧光强度二维散点图;(C)测量的R/G平均值与设计的R/G值的线性相关性,每个样本至少统计1000个阳性液滴。
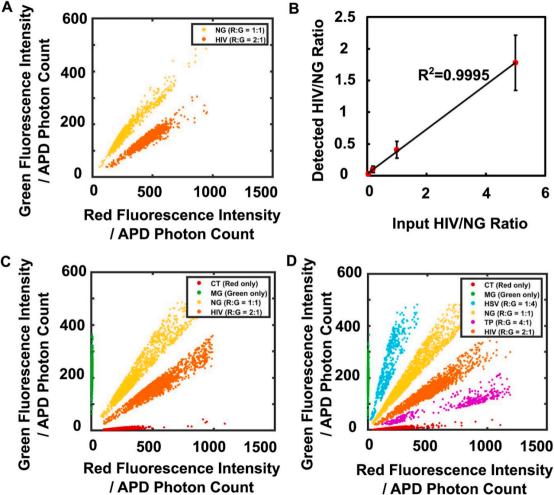
图3 ddRFC的多重检测能力验证,所用的模板全是合成的寡核苷酸。(A)NG和HIV混合样本检测结果中各至少1000个阳性液滴的红色和绿色荧光强度的二维散点图;(B)HIV与NG比值的测量值与理论值之间的线性关系(R2=0.9995,n=3);(C)NG、HIV、CT和MG混合样本检测结果中各至少1000个阳性液滴的红色和绿色荧光强度的二维散点图;(D)NG、HIV、CT、MG、CT和HSV混合样本检测结果中各至少1000个阳性液滴的红色和绿色荧光强度的二维散点图。
总的来说,该团队发展的ddRFC具有以下创新性优势:1)利用成环锁式探针为每个目标基因分配了预先设计的荧光强度比值,消除了“单色单靶标”存在的光谱重叠的影响问题;2)仅用2个标准荧光基团即可实现6种性传播病毒的检测,具有较强的多重可扩展能力;3)只需改变分子信标结合位点的数量,无需改变HRCA的引物和更换分子信标,经济高效。不过,本文中该方法在定量能力和实际临床样本上确无过多体现。但是,随着进一步的改进和发展,ddRFC仍有很大潜力成为大规模多重核酸检测的强大的dNAATs平台,作为未来更多疾病的诊断工具。
原文链接:https://doi.org/10.1016/j.bios.2020.112499
来源:微生物安全与健康网
链接:https://www.mbiosh.com/column/testing-technology/testing-technology-method/28023






